Що таке ОГМ і чому вони важливі?
 Безпосереднім поштовхом до відкриття олігосахаридів грудного молока (ОГМ) стали намагання з’ясувати підвищену смертність дітей, позбавлених грудного вигодовування (ГВ), що досягала 30% [2, 3]. Ще у 1886 р. відомий лікар і мікробіолог Теодор Ешеріх (Theodor Escherich) вперше виявив взаємозв’язок між фізіологією травлення у дітей та кишковими бактеріями, а кількома роками пізніше, в 1900 р., його колишній студент Ернст Моро (Ernst Moro) описав відмінності бактеріальної композиції стільця немовлят на грудному та штучному вигодовуванні (ШВ) (рис. 1). Проте компонент, що визначає склад кишкової мікробіоти (КМБ), залишався невідомим, хоча й виявлено наявність невідомої фракції вуглеводів, на додаток до лактози — «гінолактози». У 1926 р. Герберт Шонфельд (Herbert Schönfeld) висунув теорію про те, що жіноче молоко містить фактор росту для Lactobacillus bifidus (пізніше цей штам віднесений до Bifidobacterium bifidus). Природа «біфідус-фактора» в той час була невідома.
Безпосереднім поштовхом до відкриття олігосахаридів грудного молока (ОГМ) стали намагання з’ясувати підвищену смертність дітей, позбавлених грудного вигодовування (ГВ), що досягала 30% [2, 3]. Ще у 1886 р. відомий лікар і мікробіолог Теодор Ешеріх (Theodor Escherich) вперше виявив взаємозв’язок між фізіологією травлення у дітей та кишковими бактеріями, а кількома роками пізніше, в 1900 р., його колишній студент Ернст Моро (Ernst Moro) описав відмінності бактеріальної композиції стільця немовлят на грудному та штучному вигодовуванні (ШВ) (рис. 1). Проте компонент, що визначає склад кишкової мікробіоти (КМБ), залишався невідомим, хоча й виявлено наявність невідомої фракції вуглеводів, на додаток до лактози — «гінолактози». У 1926 р. Герберт Шонфельд (Herbert Schönfeld) висунув теорію про те, що жіноче молоко містить фактор росту для Lactobacillus bifidus (пізніше цей штам віднесений до Bifidobacterium bifidus). Природа «біфідус-фактора» в той час була невідома.

Справжній прорив у вивченні ОГМ досягнутий у результаті спільної роботи хіміка Річарда Куна (Richard Kuhn) та педіатра Пола Гьєрджі (Paul György), який був учнем Е. Моро. Вчені довели, що «біфідус-фактор» ГМ складається з олігосахаридів, зокрема, N-ацетилглюкозаміну. У наступні роки групами Р. Куна та Ж. Монтрея було ідентифіковано та описано ще десятки окремих ОГМ. Але подальше розшифрування фракції ОГМ стало можливим із впровадженням нових методів, зокрема, мас-спектрометрії, що дозволило описати і дати характеристику більшій кількості ОГМ.
Роль грудного молока в захисті немовляти. ОГМ, поряд із живими клітинами та імуноглобулінами, забезпечує захист від інфекцій та дозрівання імунної системи.
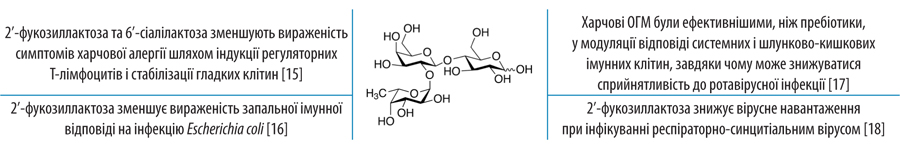
У кількісному відношенні вони займають 3-тє місце, після лактози та ліпідів. Їхній вміст становить 20–25 г/л у молозиві та 5–15 г/л у зрілому молоці. Склад ОГМ жіночого молока є унікальним та включає більше 150 структурно відмінних олігосахаридів, які розділяють на 3 основні сімейства залежно від структурних груп на одному з кінців молекули (фукоза, сіалова кислота тощо), тоді як інший кінець утворений лактозою (рис. 2). Характерні структурні особливості визначають функціональність ОГМ [4]. Наприклад, специфічні α1-2-фукозильовані ОГМ мають захисну антиадгезивну властивість проти Campylobacter jejuni — однієї з найпоширеніших причин бактеріальної діареї. Але в силу видової специфічності ті самі ОГМ не діють проти Entamoeba histolytica, найпростішого, який викликає гостру або хронічну діарею. Одночасне фукозилювання та сіалізування деяких із ОГМ може захистити немовлят від надмірних імунних реакцій завдяки гальмуванню активації лейкоцитів.

4 способи, якими ОГМ може підтримувати імунітет
1) Сприяють росту корисних бактерій:
- відіграють роль мікробіологічного субстрату для росту біфідобактерій, забезпечуючи для них переваги по відношенню до патогенної мікрофлори;
- перешкоджають росту бактерій родини Enterobacteriaceae, виду Escherichia coli, класу Clostridia.
2) Захищають кишечник від інфекцій та інвазій:
- можуть відігравати роль приманки для патогенів;
- заважають адгезії патогенних мікроорганізмів до стінок.
3) Підтримують бар’єрну функцію кишечнику:
- безпосередньо взаємодіють із епітеліальними клітинами, модулюючи появу певних гліканів на їх поверхні;
- підсилення експресії деяких генів із модифікацією гліканового складу діє як альтернативний механізм, що заважає проникненню патогенів у клітини.
4) Модулюють імунну відповідь:
- сприяють кращому балансу між лейкоцитами із досягненням рівноваги між Т-хелперами 1-го та 2-го типів (Th1/Th2);
- таким чином прискорюють дозрівання природного імунітету дитини, позбавляючи від переважання Th2, що зумовлює схильність до алергічних та аутоімунних реакцій.
Які фактори впливають на олігосахариди в грудному молоці людини?
Різні жінки синтезують відмінні набори олігосахаридів, а загальна кількість та відносний вміст ОГМ змінюються протягом лактації [6]. Так, близько 80% жінок у світі секретують фукозильовані ОГМ у значній кількості [7]. Поряд із генетично детермінованими відмінностями існує різниця в представленості різних видів ОГМ, пов’язаних із соматичним статусом жінки та факторами довкілля. Зокрема, загальна кількість ОГМ значно нижча у жінок з індексом маси тіла (ІМТ) 14–18, ніж з ІМТ 24–28. Чи впливає на синтез ОГМ вживання окремих нутрієнтів, ще потрібно з’ясувати.
Крім різниці в представленості різних видів ОГМ між жінками існують відмінності залежно від стадії лактації. Загальна кількість ОГМ є найвищою в молозиві та нижчою — у зрілому молоці. Концентрація сіалізованих ОГМ вища в перші тижні після пологів і знижується протягом періоду ГВ. Повідомляється, що молоко матерів, які народжують недоношених дітей, має значно вищі концентрації ОГМ порівняно з «молоком для доношених» [8].
Основний метаболізм ОГМ
Стійкість ОГМ до низьких значень pH шлунка, панкреатичних та кишкових ферментів встановлена спочатку in vitro [3], а згодом — на підставі даних клінічних досліджень, проведених у 1980–1990 рр. Зокрема, встановлено, що ОГМ досягають дистальних відділів кишечнику і потрапляють у стул немовлят в інтактному вигляді. У пізніших роботах була висунута теорія про багатоступінчастий процесинг ОГМ, який залежить від віку дитини, групи крові та режиму вигодовування.
На першому етапі (від народження до 2-го місяця життя) в стулі дитини виявляються як сіалізовані, так і несіалізовані ОГМ, які подібні, але не ідентичні тим, що є у ГМ у цей час. Це свідчить про мінімальний обсяг утилізації ОГМ та переважно захисну функцію ОГМ у цей період. На другому етапі стул немовлят містить велику кількість продуктів деградації ОГМ, які значно відрізняються від олігосахаридів у відповідних зразках ГМ. На третьому етапі, який починається з моменту введення прикорму, ОГМ не виявляють у стулі дітей, що пов’язано з їх повною утилізацією представниками мікробіоти.
Особливий інтерес дослідників викликала публікація Rudloff та співавторів [9], якими вперше було показано наявність інтактних ОГМ у сечі недоношених дітей, що перебувають на ГВ. Ці результати дозволили припустити, що ОГМ можуть абсорбуватися з кишечнику і надходити в системний кровотік. Ця гіпотеза підтверджена в ході подальших досліджень.
Роль OГМ у сприянні росту корисних бактерій
Кишкова мікробіота відіграє важливу роль у дозріванні бар’єрної функції та стимуляції розвитку імунітету. Її формування починається ще у внутрішньоутробний період завдяки плаценті та амніотичній рідині. Під час пологів відбувається первинна колонізація кишечнику мікрофлорою матері. У подальшому різноманітність мікробного пейзажу збільшується під впливом типу вигодовування, застосування протимікробних препаратів та мікробіому шкіри матері.
ГМ є цінним джерелом корисних бактерій та біологічно-активних речовин, таких як ОГМ, що сприяють формуванню нормальної мікробіоти, яка відіграє визначальну роль у дозріванні імунної системи. У дітей, що перебувають на ГВ, порівняно з тими, хто отримує суміші, відмічають у кишечнику більше корисних біфідобактерій. Їх частка може досягати 60–90% усього загалу КМБ дитини, що перебуває на ГВ, тоді як за його відсутності мікробний пейзаж більше схожий на такий у дорослих, з переважанням бактерій, що таксономічно належать до Bacteroides, Clostridia, Staphylococcus, Streptococcus та Enterobacteriaceae.
Імунотропні та інші системні ефекти ОГМ
Близько 1–2% ОГМ всмоктуються та потрапляють у кровотік, тому у плазмі дитини, що перебуває на ГВ, їх визначають у концентрації 1–133 мг/л. ОГМ чинять системний вплив, що не залежить від мікробіоти. Зокрема, безпосередньо взаємодіють із кишковоасоційованою лімфоїдною тканиною (КАЛТ), модулюючи її імунну відповідь [10].
Окремі ОГМ відіграють ключову роль у дозріванні кишкової мікробіоти та забезпеченні імунного захисту немовляти. Так, згідно з результатами рандомізованого подвійного сліпого контрольованого дослідження, у немовлят, яких годують сумішшю, доповненою 2-фукозиллактозою, зафіксовано нижчі профілі запальних цитокінів у плазмі крові, подібні до референтної групи, яка перебуває на ГВ [11].
Відповідно до результатів дослідження в паралельних групах додавання цих ОГМ дo початкової суміші для немовлят уподібнює склад мікробіоти стулу та її метаболічні ознаки до тих, що виявлені у немовлят на ГВ [12].
Згідно з результатами рандомізованого плацебо-контрольованого дослідження достатній рівень 2-фукозиллактози у ГМ для вигодовування немовлят, народжених шляхом кесаревого розтину, зумовлює зниження ризику пов’язаної з IgE екземи у віці 2 років [13].
Ще одним доказом того, що фукозильовані ОГМ, такі як 2-фукозиллактоза, стимулюють розвиток корисних біфідобактерій, є дослідження стану мікробіоти дітей на ГВ залежно від генетично зумовленої здатності жінки секретувати 2-фукозиллактозу у ГМ [14]. Так, домінування біфідобактерій (108,5 геномного еквівалента на 1 г випорожнень) наставало раніше (60% порівняно із 37,5% на 6-й день) і частіше (80% порівняно із 50% на 120-й день) у немовлят, яких годували матері-секретори, ніж несекретори (рис. 3).

Захисні переваги OГМ проти інфекцій та алергії
Бар’єрна функція кишечнику забезпечує складний зв’язок між організмом та навколишнім середовищем, що модулюється кишковою мікробіотою, склад якої значною мірою залежить від ОГМ. Досить корисними для розуміння фізіологічної ролі ОГМ стали преклінічні дослідження (рис. 4).
Клінічне дослідження свідчить, що немовлята, які отримували ГМ із високим вмістом 2-фукозильованих ОГМ, мали у статистично значущому ступені нижчу частоту діареї [19]. Згідно з результатами іншого обсерваційного дослідження молоко з більш високим співвідношенням 2-зв’язаних до 2-не-зв’язаних фукозильованих ОГМ забезпечує більший захист від діареї немовлят [20]. ГМ із такими особливостями складу навіть захищає від постнатальної передачі ВІЛ-інфекції [21].
Результати доклінічних досліджень також містять аргументи щодо ролі ОГМ у зниженні ризику розвитку інфекцій дихальних шляхів (рис. 5).

Роль ОГМ у профілактиці некротизуючого ентероколіту
Некротизуючий ентероколіт (НЕК) є тяжким запальним захворюванням із високим ризиком системних ускладнень, що уражує переважно недоношених немовлят. Він розвивається у 5–10% немовлят із дуже низькою (менше 1500 г) масою тіла при народженні. Летальність при цьому досягає 10–50%. Факторами ризику НЕК, окрім недоношеності, є вигодовування звичайними сумішами, тривале парентеральне харчування, дисбіоз кишечнику та незрілість імунної системи. Для складу мікробіому кишечнику при НЕК характерна підвищена відносна кількість Proteobacteria та зменшена — Firmicutes і Bacteroidetes [25].
ГМ чинить захисний вплив щодо розвитку НЕК, тому недоношені діти, які перебувають виключно на ГВ, мають у 6–10 разів нижчу вірогідність захворіти на НЕК [26]. ОГМ знижує ризик розвитку НЕК завдяки кільком важливим механізмам, що доведено багатьма доклінічними дослідженнями (рис. 6).

Кілька обсерваційних, у тому числі одне когортне дослідження підтвердили та додатково розкрили роль ОГМ у профілактиці НЕК. При цьому несекреторний статус матері є предиктором ризику розвитку НЕК та підвищеної смертності [28].
Чим галактоолігосахариди (ГОС)/фруктоолігосахариди (ФОС) відрізняються від ОГМ?
ОГМ складні за будовою та високоспецифічні. У суміші для немовлят додають олігосахариди із різним походженням та властивостями:
- ГОС, що отримують шляхом ензимного синтезу з галактози;
- ФОС отримують з інуліну, цикорію та інших рослин;
- кислі олігосахариди, похідні пектину, — із цитрусових.
Вважається, що ГОС та ФОС мають пребіотичні властивості, сприяючи росту корисної мікрофлори. Проте ГОС та ФОС у структурному відношенні суттєво відрізняються від ОГМ [29]. Вони складаються з галактози, глюкози та фруктози, тоді як ОГМ мають більше «будівельних блоків», зокрема, фукозу, сіалову кислоту, N-ацетилглюкозамін, та не містять фруктози. Біологічна активність ОГМ тісно пов’язана із їх структурою, тому малоймовірно, щоб ГОС та ФОС у складі сумішей могли взяти на себе біологічну роль ОГМ. Результати досліджень свідчать, що вони не забезпечують імунотропних переваг ОГМ [4, 6, 29].
ОГМ надають й інші переваги в захисті від інфекцій, не властиві ГОС та ФОС. Так, ОГМ, особливо фукозильовані та сіалізовані, покращують імунний захист, діючи як приманка для патогенів, з якою вони з’єднуються замість рецепторів на стінках кишечнику, попереджуючи адгезію бактерій [2, 5]. Таким чином, ОГМ можуть безпосередньо захищати від інфекцій.
Фукозильовані та сіалізовані ОГМ безпосередньо взаємодіють із епітеліальними клітинами, сприяючи появі певних гліканів на їх поверхнях [4, 30]. Модуляція гліканів перешкоджає прикріпленню мікроорганізмів до стінок кишечнику, попереджаючи інфікування. Тож, ОГМ підтримують бар’єрну функцію кишечнику, тоді як ГОС та ФОС не можуть підтримати імунний захист таким чином.
У 2010 р. Європейське агентство з безпеки харчових продуктів (European Food Safety Authority — EFSA) оцінило вплив ГОС та ФОС, які також називають неперетравлюваними олігосахаридами, на ріст різних, переважно патогенних, кишкових бактерій. Вивчивши матеріали 5 клінічних досліджень, EFSA дійшло висновку про відсутність доказів щодо пригнічення патогенних бактерій завдяки ГОС та ФОС. 5 років потому, роблячи висновок щодо незамінних компонентів сумішей для немовлят та наступних сумішей, EFSA підтвердило своє більш раннє твердження про відсутність переконливих доказів щодо будь-якого позитивного впливу неперетравлюваних олігосахаридів на здоров’я немовляти [31]. З огляду на це було вказано на відсутність необхідності додавати їх у дитячі суміші.
Додавання до сумішей 2’-фукозиллактози, структурно ідентичної ОГМ
Три інтервенційні дослідження свідчать про позитивний вплив додавання в суміші фукозильованих ОГМ щодо нормального розвитку немовлят, а також їхню безпеку та хорошу переносимість.
У рамках рандомізованого контрольованого дослідження у немовлят, що отримували суміш із додаванням ОГМ (2-фукозиллактози та лакто-N-неотетраози), порівняно із звичайною сумішшю:
- рідше відзначали симптоми харчової непереносимості (здуття живота, зригування, блювання);
- тенденцію до більш м’якого стулу у віці 1 міс та досягнення цим показником статистичної значущості (р=0,021) у віці 2 міс;
- аналогічні поведінкові особливості (щодо занепокоєння, збудливості та колік).
Хорошу переносимість суміші, що збагачена коротколанцюговими фруктоолігосахаридами та 2-фукозиллактозою, продемонстровано також в іншому подвійному сліпому контрольованому багатоцентровому дослідженні [32].
У 2015 р. регулятори ЄС та США дійшли сприятливих висновків щодо застосування ОГМ (табл. 1).
Таблиця 1. Поточні нормативні перспективи додавання 2-фукозиллактози та лакто-N-неотетраози до сумішей для немовлят
| ЄС [31] | FDA [33, 34] |
|---|---|
| 2-фукозиллактоза може бути додана у суміші як для немовлят, так і більш старших дітей, у концентрації до 1,2 г/л окремо, а також разом із лакто-N-неотетраозою в концентрації до 0,6 г/л, у співвідношенні 2:1 | 2-фукозиллактоза та лакто-N-неотетраоза визнані в цілому безпечними (generally recognized as safe — GRAS) при застосуванні згідно із запланованим призначенням, у концентрації до 2,4 та 0,6 г/л відповідно |
Потенційні переваги для імунітету від додавання HMO-2’FL в суміші для немовлят
Згідно з результатами рандомізованого контрольованого дослідження додавання ОГМ (2-фукозиллактози та лакто-N-неотетраози) до складу суміші сприяло формуванню мікробіоти, схожої на таку немовлят, що перебувають на ГВ [35]. Цікаво, що ті з немовлят, які у віці 3 міс мали характерний для ГВ тип мікробіоти, з нижчою вірогідністю отримували антибіотики до кінця першого року життя.
У проспективному рандомізованому контрольованому дослідженні продемонстровано, що дитячі суміші із додаванням комплексу ОГМ безпечні з точки зору нормального росту та добре переносяться [36]. До того ж частота респіраторних та кишкових інфекцій у дітей, які отримували досліджувану суміш із додаванням двох ОГМ, була на 30–40% нижчою порівняно з контрольною групою [37]. Згідно з результатами багатоцентрового рандомізованого дослідження щодо немовлят, які отримували суміш з ОГМ (порівняно з контрольною групою), зафіксовано значно менше повідомлень батьків (р=0,004–0,047) про бронхіт протягом 4 (2,3% проти 12,6%), 6 (6,8% проти 21,8%) та 12 міс (10,2% проти 27,6%); інфекцію нижніх дихальних шляхів протягом 12 міс (19,3% проти 34,5%); застосування жарознижувальних засобів протягом 4 міс (15,9% проти 29,9%) і антибіотиків протягом 6 (34,1% проти 49,4%) та 12 міс (42,0% проти 60,9%) [38].
Про численні переваги для імунітету завдяки фукозильованим ОГМ свідчить цілий ряд обсерваційних досліджень (табл. 2).
Таблиця 2. Вплив ОГМ на імунну систему немовляти (за матеріалами www.nestlenutrition-institute.org)
| Вищий рівень 2’-фукозильованих ОГМ у ГМ |
Велика кількість біфідобактерій Менше проблем із дихальною та травною системами Зниження смертності серед дітей матерів із ВІЛ-інфекцією Зниження смертності та частоти НЕК у недоношених |
| Вищий рівень 2’-фукозиллактози |
Нижча частота діареї, викликаної Campilobacter Нижчий рівень IGE-асоційованої алергії серед дітей, народжених шляхом кесаревого розтину |
| Велика кількість лакто-N-неотетраози | Вищий рівень B. infantis |
Нещодавно опубліковано результати багатоцентрового рандомізованого дослідження, згідно з якими дитяча суміш NAN® SUPREME PRO◊ 3 зі спеціальним комплексом 5 ОГМ (2′-фукозиллактоза, 2′,3-дифукозиллактоза, лакто-N-тетраоза, 3′-сіалілактоза та 6′-сіалілактоза) стимулює розвиток мікробіоти кишечнику та покращує маркери його дозрівання [39].
Висновок
ОГМ — унікальна складова, що пристосована до потреб немовлят, які перебувають на ГВ. Вони сприяють росту корисних бактерій, захищають від інфекцій та інвазій, підтримують бар’єрну функцію кишечнику та модулюють імунну відповідь. Численні дослідження свідчать, що ОГМ відіграють важливу роль у формуванні опірності організму проти ряду пошкоджувальних факторів. Зокрема, діти, які їх отримують, менше хворіють на кишкові та респіраторні інфекції, алергічні захворювання. У них рідше відмічають коліки, занепокоєння, симптоми харчової непереносимості (здуття живота, зригування, блювання).
Перше дослідження (міжнародне подвійне сліпе рандомізоване), у якому вивчали використання комплексу з 5 ОГМ, свідчить, що розроблена суміш підтримує розвиток імунної системи та функції кишкового бар’єра, зміщує мікробіом кишечнику ближче до такого у немовлят, які перебувають на ГВ, з більш високим вмістом біфідобактерій, зокрема B. infantis, і меншим — токсигенного Clostridioides difficile [40]. Ще одне рандомізоване подвійне сліпе дослідження показало, що нова суміш з 5 ОГМ сприяє нормальному росту, функціонуванню шлунково-кишкового тракту та безпечному вигодовуванню здорових доношених дітей [41]. Тривають дослідження сумішей із певними пропорціями різних ОГМ з метою задовольнити індивідуальні потреби немовлят із низькою масою тіла при народженні, підвищеним ризиком розвитку алергічних захворювань, цукрового діабету, запальних захворювань кишечнику, аутизму тощо. Таким чином покладено початок створенню персоналізованих замінників ГМ.
Список використаної літератури
- 1. Reverri E.J., Devitt A.A., Kajzer J.A. et al. (2018) Review of the clinical experiences of feeding infants formula containing the human milk oligosaccharide 2′-fucosyllactose. Nutrients; 10(10): 1346.
- 2. Bode L. (2012a) Human milk oligosaccharides: every baby needs a sugar mama. Glycobiology, Sep; 22(9): 1147–62.
- 3. Makarova E.G., Netrebenko O.K., Ukraintsev S.E. (2018) Breast milk oligosaccharides: the history of discovery, structure and protective functions. Pediatria; 97(4): 152–160.
- 4. Bode L. (2012b) Forscher entdecken einzigartige Muttermilch-Oligosaccharide [Researchers discover a unique human milk oligosaccharide]. Kinderkrankenschwester. May; 31(5): 214. German. PMID: 22685944.
- 5. Smilowitz J.T., Lebrilla C.B., Mills D.A. et al. (2014) Breast milk oligosaccharides: structure-function relationships in the neonate. Ann. Rev. Nutr.; 34: 143–69.
- 6. Bode L., Jantscher-Krenn E. (2012) Structure-function relationships of human milk oligosaccharides. Adv. Nutr., May 1; 3(3): 383S–91S. doi: 10.3945/an.111.001404. PMID: 22585916; PMCID: PMC3649474.
- 7. Ruiz-Palacios G.M., Cervantes L.E., Ramos P. et al. (2003) Campylobacter jejuni binds intestinal H(O) antigen (Fuc alpha 1, 2Gal beta 1, 4GlcNAc), and fucosyloligosaccharides of human milk inhibit its binding and infection. J. Biol. Chem., Apr 18; 278(16): 14112–20.
- 8. Gabrielli O., Zampini L., Galeazzi T. et al. (2011) Preterm milk oligosaccharides during the first month of lactation. Pediatrics; 128: e1520–31.
- 9. Rudloff S., Obermeier S., Borsch C. et al. (2006) Incorporation of orally applied (13)C-galactose into milk lactose and oligosaccharides. Glycobiology, Jun; 16(6): 477–87.
- 10. Donovan S.M., Comstock S.S. (2016) Human Milk Oligosaccharides Influence Neonatal Mucosal and Systemic Immunity. Ann. Nutr. Metab.; 69 (Suppl. 2): 42–51.
- 11. Goehring K.C., Marriage B.J., Oliver J.S. et al. (2016) Similar to Those Who Are Breastfed, Infants Fed a Formula Containing 2’-Fucosyllactose Have Lower Inflammatory Cytokines in a Randomized Controlled Trial. J. Nutr., Dec; 146(12): 2559–2566.
- 12. Steenhout P., Sperisen P., Martin F.-P. et al. (2016) Term Infant Formula Supplemented with Human Milk Oligosaccharides (2’Fucosyllactose and Lacto-N-neotetraose) Shifts Stool Microbiota and Metabolic Signatures Closer to that of Breastfed Infants. The FASEB Journal, 30: 275.7–275.7.
- 13. Sprenger N., Odenwald H., Kukkonen A.K. et al. (2017) FUT2-dependent breast milk oligosaccharides and allergy at 2 and 5 years of age in infants with high hereditary allergy risk. Eur. J. Nutr., Apr; 56(3): 1293–1301.
- 14. Lewis Z.T., Totten S.M., Smilowitz J.T. et al. (2015) Maternal fucosyltransferase 2 status affects the gut bifidobacterial communities of breastfed infants. Microbiome. Apr 10; 3: 13.
- 15. Castillo-Courtade L., Han S., Lee S. et al. (2015) Attenuation of food allergy symptoms following treatment with human milk oligosaccharides in a mouse model. Allergy, Sep; 70(9): 1091–102.
- 16. He Y., Liu S., Kling D.E. et al. (2016) The human milk oligosaccharide 2’-fucosyllactose modulates CD14 expression in human enterocytes, thereby attenuating LPS-induced inflammation. Gut., Jan; 65(1): 33–46.
- 17. Comstock S.S., Li M., Wang M. et al. (2017) Dietary Human Milk Oligosaccharides but Not Prebiotic Oligosaccharides Increase Circulating Natural Killer Cell and Mesenteric Lymph Node Memory T Cell Populations in Noninfected and Rotavirus-Infected Neonatal Piglets. J. Nutr., Jun; 147(6): 1041–1047.
- 18. Duska-McEwen G., Senft A.P., Ruetschilling T.L. (2014) Human Milk Oligosaccharides Enhance Innate Immunity to Respiratory Syncytial Virus and Influenza in Vitro. Food and Nutrition Sciences, 56: 1387–1398.
- 19. Morrow A.L., Rangel J.M. (2004) Human milk protection against infectious diarrhea: implications for prevention and clinical care. Semin. Pediatr. Infect. Dis., Oct; 15(4): 221–8. doi: 10.1053/j.spid.2004.07.002. PMID: 15494945.
- 20. Newburg D.S., Ruiz-Palacios G.M., Altaye M. (2004) Innate protection conferred by fucosylated oligosaccharides of human milk against diarrhea in breastfed infants. Glycobiology, Mar; 14(3): 253–63.
- 21. Kuhn L., Kim H.Y., Hsiao L. et al. (2015) Oligosaccharide composition of breast milk influences survival of uninfected children born to HIV-infected mothers in Lusaka, Zambia. J. Nutr., Jan; 145(1): 66–72.
- 22. Ackerman D.L., Craft K.M., Doster R.S. et al. (2018) Antimicrobial and Antibiofilm Activity of Human Milk Oligosaccharides against Streptococcus agalactiae, Staphylococcus aureus, and Acinetobacter baumannii. ACS Infect. Dis., Mar 9; 4(3): 315–324.
- 23. Ruiz L., Espinosa-Martos I., García-Carral C. et al. (2017) What’s Normal? Immune Profiling of Human Milk from Healthy Women Living in Different Geographical and Socioeconomic Settings. Front Immunol., Jun 30; 8: 696.
- 24. Idänpään-Heikkilä I., Simon P.M., Zopf D. et al. (1997) Oligosaccharides interfere with the establishment and progression of experimental pneumococcal pneumonia. J. Infect. Dis., Sep; 176(3): 704–12.
- 25. Pammi M., Cope J., Tarr P.I. et al. (2017) Intestinal dysbiosis in preterm infants preceding necrotizing enterocolitis: a systematic review and meta-analysis. Microbiome, Mar 9; 5(1): 31.
- 26. Lucas A., Cole T.J. (1990) Breast milk and neonatal necrotising enterocolitis. Lancet, Dec 22–29; 336(8730): 1519–23.
- 27. Caplan M.S. (2017) Paediatrics: Are human milk oligosaccharides the magic bullet for necrotizing enterocolitis? Nat. Rev. Gastroenterol. Hepatol., Jul; 14(7): 394–395.
- 28. Morrow A.L., Meinzen-Derr J., Huang P. et al. (2011) Fucosyltransferase 2 non-secretor and low secretor status predicts severe outcomes in premature infants. J. Pediatr., May; 158(5): 745–51.
- 29. Sela D.A., Mills D.A. (2010) Nursing our microbiota: molecular linkages between bifidobacteria and milk oligosaccharides. Trends Microbiol. Jul; 18(7): 298–307.
- 30. Jantscher-Krenn E., Bode L. (2012) Human milk oligosaccharides and their potential benefits for the breast-fed neonate. Minerva Pediatr., Feb; 64(1): 83–99.
- 31. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA) (2015) Safety of 2’-O-fucosyllactose as a novel food ingredient pursuant to Regulation (EC) No 258/97. EFSA Journal; 13(7): 4184.
- 32. Kajzer J., Oliver J., Marriage B. (2016) Gastrointestinal Tolerance of Formula Supplemented with Oligosaccharides. The FASEB Journal, 30: 671.4–671.4.
- 33. FDA (2015) Agency Response Letter GRAS Notice No. GRN 000546. 2’-Ofucosyllactose, filed by Glycom A/S. Closure date: Aug. 14, 2015. Available online: http://www.accessdata.fda.gov/scripts/fdcc/?set=GRASNotices&id=546.
- 34. FDA (2015) Agency Response Letter GRAS Notice No. GRN 000571. 2’-fucosyllactose, filed by Jennewein Biotechnologie, GmgH. Closure date: November 6, 2015. Available online: http://www.fda.gov/Food/IngredientsPackagingLabeling/GRAS/NoticeInventory/ucm484540.htm.
- 35. Berger B. et al. (2016) Stool Microbiota in term Infants fed Formula supplemented with synthetic Human Milk Oligosaccharides is associated with reduced Likelihood of Medication. J. Pediatr. Gastroenterol. Nutr.; 63 (Suppl. 2): S406.
- 36. Marriage B.J., Buck R.H., Goehring K.C. et al. (2015) Infants Fed a Lower Calorie Formula With 2’FL Show Growth and 2’FL Uptake Like Breast-Fed Infants. J. Pediatr. Gastroenterol. Nutr.; 61: 649–658.
- 37. Vandenplas Y., Żołnowska M., Berni Canani R. et al. (2022) Cinnamon Study Investigator Group. Effects of an Extensively Hydrolyzed Formula Supplemented with Two Human Milk Oligosaccharides on Growth, Tolerability, Safety and Infection Risk in Infants with Cow’s Milk Protein Allergy: A Randomized, Multi-Center Trial. Nutrients, Jan 26; 14(3): 530.
- 38. Puccio G., Alliet P., Cajozzo C. et al. (2017) Effects of Infant Formula With Human Milk Oligosaccharides on Growth and Morbidity: A Randomized Multicenter Trial. J. Pediatr. Gastroenterol. Nutr. Apr; 64(4): 624–631.
- 39. Bosheva M., Tokodi I., Krasnow A. et al. (2022) 5 HMO Study Investigator Consortium. Infant Formula With a Specific Blend of Five Human Milk Oligosaccharides Drives the Gut Microbiota Development and Improves Gut Maturation Markers: A Randomized Controlled Trial. Front Nutr., Jul 6; 9: 920362.
- 40. Lasekan J., Choe Y., Dvoretskiy S. et al. (2022) Growth and Gastrointestinal Tolerance in Healthy Term Infants Fed Milk-Based Infant Formula Supplemented with Five Human Milk Oligosaccharides (HMOs): A Randomized Multicenter Trial. Nutrients. Jun 24; 14(13): 2625.





