Діагноз «рак нирки» встановлюють у медичних закладах на основі ультразвукової діагностики (УЗД) та спіральної комп’ютерної томографії (СКТ). При пухлині нирки до 4 см — на основі матеріалів гістологічного (цитологічного) дослідження біопсії та на основі морфологічного дослідження післяопераційного матеріалу.
Перед початком спеціалізованого лікування необхідне всебічне обстеження з метою правильного встановлення ознак злоякісного пухлинного росту, стадії захворювання.
Діагностика раку нирки
Діагностика спрямована на чітке встановлення стадії захворювання, визначення загального стану хворого, показань і протипоказань до виду лікування, у тому числі з боку суміжних органів і систем.
Класифікація та стадіювання
Загальноприйнятою системою стадіювання нирково-клітинного раку (НКР) служить Міжнародна класифікація стадій злоякісних новоутворень (TNM), рекомендована для клінічної та наукової роботи. На сьогодні в Україні, як і в багатьох інших країнах, користуються класифікацією TNM, запропонованою у 2002 р. Міжнародною протираковою спілкою, 6-го видання із доповненням у 2009 р., яка чітко висвітлює ступінь розповсюдження пухлинного процесу, з метою вирішення лікувальної тактики.
Т — первинна пухлина
- Тх — первинна пухлина не може бути оцінена
- Т0 — немає даних про первинну пухлину
- Т1 — пухлина ≤7 см у найбільшому діаметрі, обмежена ниркою
- Т1а — пухлина ≤4 см у найбільшому діаметрі, обмежена ниркою
- Т1b — пухлина >4 см, але ≤7 см у найбільшому діаметрі, обмежена ниркою
- Т2 — пухлина >7 см у найбільшому діаметрі, обмежена ниркою
- Т2а — пухлина >7 см, але ≤10 см у найбільшому діаметрі, обмежена ниркою
- Т2b — пухлина >10 см у найбільшому діаметрі, обмежена ниркою
- Т3 — пухлина поширюється на великі вени або інвазія в навколониркову клітковину, але не в суміжну надниркову залозу і не виходить за межі фасції Героти
- Т3а — пухлина поширюється на ниркову вену чи її сегментарні гілки, або пухлина проростає в паранефральну клітковину чи/або нирковий синус, але не виходить за межі фасції Героти
- Т3b — пухлина поширюється на нижню порожнисту вену нижче діафрагми
- Т3с — пухлина поширюється на нижню порожнисту вену або її стінку вище діафрагми
- Т4 — пухлина поширюється за межі фасції Героти (включає проростання в суміжну надниркову залозу)
N — регіонарні лімфатичні вузли
- Nх — регіонарні лімфатичні вузли не можуть бути оцінені
- N0 — немає ознак метастазування в регіонарні лімфатичні вузли
- N1 — метастази в одному лімфатичному вузлі
- N2 — метастазування більше, ніж в один регіонарний лімфатичний вузол
- М — віддалені метастази
- М0 — немає віддалених метастазів
- М1 — віддалені метастази
Градація ядра пухлинної клітини за Фурманом є найбільш загальновизнаною системою гістологічної градації раку нирки. Незважаючи на різницю інтерпретації, що залежить від морфолога, ступінь анаплазії клітинного ядра є незалежним прогностичним фактором.
G — гістологічна градація
- Gх — ступінь диференціювання не може бути оцінений
- G1 — високодиференційована пухлина
- G2 — помірнодиференційована пухлина
- G3-4 — низькодиференційована/недиференційована пухлина
Крім градації за Фурманом визначають гістологічні підтипи, саркоматоїдні елементи, мікросудинну інвазію, вогнища некрозу пухлини, а також інвазію в порожнисту систему нирки.
Загалом, розрізняють три основних види гістологічних підтипів НКР:
- світлоклітинний рак (80–90%);
- папілярний рак (10–15%);
- хромофобний рак (4–5%).
Серед пацієнтів із папілярним раком виявлено дві прогностично різні групи:
- Тип 1 — пухлини з низьким злоякісним потенціалом, з наявністю хромофільної цитоплазми. Сприятливий прогноз.
- Тип 2 — пухлина високого злоякісного потенціалу з еозинофільною цитоплазмою та високою схильністю до метастазування.
Розподіл НКР на вищеописані підтипи підтверджено на молекулярному рівні за допомогою генетичних та цитогенетичних досліджень.
Залежно від розмірів пухлини (Т), наявності місцевих (N) та віддалених (M) метастазів проводять групування хворих на НКР за стадіями (табл. 1).
| Стадія І | Т1 | N0 | М0 |
| Стадія ІІ | Т2 | N0 | М0 |
| Стадія ІІІ | Т1, Т2, Т3 | N1, N1, N0, N1 | М0, М0, M0 |
| Стадія IV | Т4
Будь-яка Т Будь-яка Т |
N0, N1, N2
Будь-яка N |
М0, М0, М1 |
Дії лікаря
Обов’язкові
1. Збір скарг та анамнестичних даних.
2. Фізикальне обстеження.
3. Лабораторне дослідження крові (загальний, біохімічний аналізи крові, коагулограма, визначення HbS Ag, реакція Вассермана) та загальний аналіз сечі.
4. Електрокардіографія (ЕКГ).
5. Фіброезофагогастродуоденоскопія (ФЕГДС).
6. СКТ органів грудної, черевної порожнини, заочеревинного простору та малого таза із внутрішньовенним контрастним підсиленням.
7. Визначення об’єму функціонуючої паренхіми нирки.
Дослідження нирок проводять за методом СКТ у положенні пацієнта на спині із внутрішньовенним контрастним підсиленням в аксіальній та коронарній проекціях та оцінюють такі параметри (в см):
довжина, ширина, висота нирки;
довжина, ширина, висота пухлинного ураження нирки.
Оскільки в більшості випадків пухлина нирки, нирка та уражена пухлиною її ділянка мають вигляд трьохосьового еліпсоїда, у моделі розрахунків використовуємо формулу обчислення об’єму еліпсоїда для визначення об’єму нирки та її пухлинного ураження.
Розглянемо трьохосьовий еліпсоїд з півосями a, b, c.
Його об’єм становить:

де: V — об’єм еліпсоїда; π — стала величина, яка дорівнює 3,14; a, b, c — півосі трьохосьового еліпсоїда (рис. 1).

Пухлина нирки може мати як екзофітний, так і ендофітний характер росту. Розглянемо випадки екзофітної та ендофітної пухлини (рис. 2).

Верхньою точкою відліку при визначенні пухлинного ураження нирки служить початок пухлинного вростання в нирку, нижньою — закінчення, медіальним краєм — медіальний край пухлини, латеральним краєм — удаваний край самої нирки (див. рис. 2а).
При ендофітному характері росту пухлини краєм пухлинного ураження нирки є край самої пухлини (див. рис. 2б).
За формулою (2) обчислюємо об’єм нирки — Vн, за формулою (3) — об’єм пухлинного ураження нирки — Vп:

Оскільки порожниста система нирки в нормі займає 4% загального об’єму нирки, тому формула (2) матиме такий вигляд:
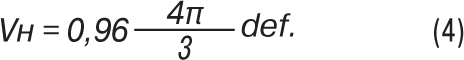
При множинних пухлинах нирки загальним об’ємом пухлинного ураження нирки буде сума всіх окремих пухлинних уражень.
Функціонуючу паренхіму нирки обчислюють за такою формулою:

Підставляючи формули (3) та (4) у формулу (5), отримуємо показник RFPV у такому вигляді:

Визначення відсотка функціонуючої паренхіми нирки дозволяє об’єктивізувати показання до органозберігаючого лікування у хворих на рак нирки.
8. NCIU-нефрометрія для визначення показань до виду оперативного втручання.
Нефрометрична система Національного інституту раку України (NCIU-nephrometry)
Суть методики нефрометрії полягає в тому, що після проведення комп’ютерної томографії (КТ) із внутрішньовенним контрастним підсиленням на знімках нирку розподіляють на інтерполярний (середній) та полярні сегменти (верхній (Upper) та нижній (Inferior)) лініями, проведеними перпендикулярно до вертикальної осі нирки по краях медіальної губи, де паренхіма нирки продовжується у нирковий жир синусів, судин чи порожнистої системи (рис. 3). Далі проводимо перпендикулярну лінію, яка відповідає вертикальній осі нирки і проходить від верхньої до нижньої інтерполярної лінії. Таким чином середній сегмент розподіляється ще на два сегменти (Nearness — близький до судинної ніжки чи медіальний та Collateral — латеральний). Склавши разом літери англійської абетки, що позначають сегменти нирки, утворюється акронім NCIU (див. рис. 3).

Якщо пухлина повністю знаходиться в одному з цих сегментів, при цьому жодна з роздільних ліній її не перетинає, тоді їй присвоюється одна велика літера, що відповідає назві цього сегмента. Якщо пухлина знаходиться як в одному, так і в іншому сегменті, але розміщення її в одному з них становить менше 15% об’єму пухлини, їй також присвоюється одна велика літера, що відповідає назві більш ураженого сегмента (наприклад U, N, С, I) (рис. 4).

Якщо пухлина знаходиться у двох сегментах, розміщення її в одному з них більше 15% об’єму пухлини, їй присвоюється велика та мала літери, де велика відповідає сегменту, в якому розміщена більша, а мала — менша частина пухлини (наприклад Un, Ic, Cn) (рис. 5).

Якщо пухлина порівну знаходиться в тому чи іншому сегменті, їй присвоюються обидві великі літери, що відповідають сегментам розміщення. При цьому першою ставиться літера складнішого щодо хірургії сегмента (наприклад NC, NI, CU) (рис. 6).

Якщо пухлина знаходиться в трьох сегментах та є переважання розміщення її в одному з них, їй присвоюються дві літери відповідно першого та другого сегментів, у якому розміщення пухлини переважає (одна велика і одна мала — при ураженні другого сегмента більше 15%, але менше 50% об’єму пухлини) чи дві великі (при однаковому об’ємі ураження обох сегментів) (наприклад Un, NC) (рис. 7).

Якщо на КТ є ознаки пухлинного проростання в надниркову залозу чи метастатичне ураження, до опису пухлини додається суфікс А (наприклад UnA, UA, IcA) (рис. 8).

У результаті опис пухлини складатиметься із двох показників: букв, що відповідають сегменту розміщення пухлини, та відсотка функціонуючої паренхіми нирки на боці ураження (наприклад UА 85%, Nu 65%, CN 73%).
При полярному чи латеральному розміщенні пухлини пороговим значенням об’єму функціонуючої паренхіми нирки, при якій доцільно виконувати резекцію, є величина понад 55%. При медіальному розміщенні пухлини основним показанням до проведення резекції нирки є розмір пухлини до 4 см.
Рекомендації щодо діагностичної оцінки НКР
1. Контрастна мультиспіральна КТ та магнітно-резонансна томографія (МРТ) черевної порожнини рекомендована при обстеженні пацієнтів з НКР. Обидва методи вважають однаково ефективними для діагностики і стадіювання.
2. Контрастна мультиспіральна КТ та МРТ черевної порожнини — найкращі методи візуалізації для характеристики і стадіювання ниркової пухлини перед операцією.
3. КТ грудної клітки рекомендується для оцінки легень і середостіння.
4. Сканування кісток скелета не рекомендується проводити рутинно.
5. Ниркову біопсію пухлини рекомендується виконувати перед проведенням абляції пухлини і системної терапії за відсутності раніше отриманих патогістологічних даних.
6. Черезшкірна біопсія рекомендується пацієнтам, які перебувають під активним спостереженням.
7. Черезшкірну біопсію пухлини нирки слід проводити під контролем коаксіальної техніки.
За показаннями:
1. Динамічна нефросцинтиграфія.
2. МРТ головного мозку.
3. Остеосцинтиграфія.
4. Ангіографія.
5. Пункційна біопсія пухлини.
6. Фіброколоноскопія.
7. Екскреторна урографія.
8. МРТ органів черевної порожнини та заочеревинного простору.
9. Консультації суміжних спеціалістів.
Догоспітальний етап
Подальшу тактику лікування після повного обстеження хворого визначає консиліумом у складі онколога, хіміотерапевта і променевого терапевта.
Дії лікаря
Повне догоспітальне обстеження хворого (якщо не виконане при діагностиці).
Госпіталізація
Рак нирки не чутливий до променевої чи хіміотерапії, тому єдино радикальним методом лікування при раку нирки є хірургічний метод. Симптоматичну променеву терапію застосовують з метою зменшення вираженості больового синдрому у пацієнтів із неоперабельними кістковими метастазами чи метастазами в головному мозку, які не реагують на проведену консервативну терапію.
Хіміотерапія як монотерапія у хворих на метастатичний НКР (мНКР) — неефективний метод лікування. Таргетна терапія показала переваги у лікуванні пацієнтів із мНКР.
Дії лікаря
Госпіталізація у відділення хірургічного профілю:
- з метою проведення хірургічного видалення пухлини чи метастазів.
Госпіталізація у відділення терапевтичного профілю з метою:
- проведення дистанційної променевої терапії на метастатичні вогнища;
- проведення таргетної терапії.
Лікування при раку нирки (зокрема амбулаторне)
Перевага віддається резекції нирки у всіх випадках, коли нирку можна зберегти. Онкологічна ефективність резекції нирки аналогічна нефректомії. Нефректомія спричиняє розвиток хронічної ниркової недостатності одразу після операції у 26%, а через 10 років — у 50% пацієнтів.
Лапароскопічний метод видалення пухлини — менш травматичний порівняно з відкритою операцією, однак визнаним недоліком є біль, тривалий час теплової ішемії та більша частка інтра- та післяопераційних ускладнень.
Показанням до малоінвазивних методів лікування (черезшкірна абляція) є маленькі, випадково виявлені пухлини коркового шару в пацієнтів похилого віку.
Лікування пацієнтів із локалізованим раком нирки
Враховуючи дані клінічних досліджень, резекція нирки показала кращі онкологічні та функціональні результати порівняно з радикальною нефректомією, незважаючи на вибраний хірургічний доступ. У вищезазначених методик не виявлено статистично достовірної різниці щодо рівня канцерспецифічної виживаності.
Висновки щодо ведення пацієнтів із локалізованим раком нирки
1. Онкологічні результати резекції нирки та радикальної нефректомії зіставні при локалізованому Т1 НКР.
2. Лапароскопічна радикальна нефректомія порівняно з відкритим оперативним втручанням полегшує післяопераційну реабілітацію.
3. Лапароскопічна та відкрита радикальна нефректомія мають зіставні онкологічні результати при Т1а–Т2а пухлинах нирки.
4. При достатньому досвіді оперуючого хірурга лапароскопічна резекція є рівноцінною альтернативною відкритої операції в певної категорії пацієнтів і має бути прерогативою спеціалізованих центрів.
5. Вибір методу хірургічного втручання залежить від досвіду та можливостей хірурга.
6. Іпсилатеральна адреналектомія при резекції нирки та радикальній нефректомії не впливає на виживаність.
7. У пацієнтів із клінічно негативними лімфовузлами недоцільним є виконання лімфодисекції при радикальній нефректомії.
8. Емболізація показана пацієнтам із неоперабельними пухлинами або вираженою супутньою патологією для покращення контролю над гематурією та больовим синдромом.
9. Лапароскопічна радикальна нефректомія порівняно з відкритим оперативним втручанням полегшує післяопераційну реабілітацію.
Лікування при локалізованому раку нирки проводять відповідно до рекомендацій
1. Хірургічне лікування рекомендоване пацієнтам із локалізованим НКР.
2. Резекція нирки має бути пріоритетною перед радикальною нефректомією, якщо це можливо.
3. Показання до резекції нирки чи нефректомії мають базуватися на основі NCIU-нефрометрії (визначенні частки функціонуючої паренхіми нирки та локалізації пухлини).
4. Виконання резекції нирки показано за наявності частки функціонуючої паренхіми нирки на боці ураження понад 55%.
5. Іпсилатеральну адреналектомію рекомендовано пацієнтам із клінічними ознаками інвазії в надниркову залозу.
6. Лімфодисекція не показана пацієнтам із локалізованими пухлинами нирок без клінічних ознак ураження лімфовузлів.
7. Лапароскопічна нефректомія показана пацієнтам з Т2-пухлинами, що не підлягають резекції нирки.
8. Із врахуванням низької доказовості клінічних досліджень кріоабляція та радіочастотна абляція не можуть бути рекомендованими методами лікування.
9. Активне спостереження, радіочастотна абляція, кріоабляція можуть бути використані у вікових пацієнтів та осіб з вираженою супутньою патологією.
10. Резекції нирки без ішемії або з мінімальною тривалістю ішемії мають переваги в подальшому функціональному стані нирки.
11. Лапароскопічну резекцію нирки необхідно виконувати у спеціалізованих центрах із великим досвідом.
Лікування при локально-розповсюдженому НКР
У додаток до висновків та рекомендацій, висвітлених у розділі «Лікування пацієнтів із локалізованим раком нирки», для локалізованого НКР додаткового висвітлення потребують методи лікування місцево-поширеного процесу.
Висновки щодо ведення пацієнтів із локально-розповсюдженим раком нирки
1. Переваги проведення лімфодисекції у пацієнтів із клінічно збільшеними лімфовузлами та її вплив на виживаність залишаються не визначеними. Лімфодисекцію доцільно проводити для стадіювання захворювання.
2. Враховуючи дані досліджень із низькою доказовою базою, рекомендовано проведення видалення пухлини нирки із тромбектомією у пацієнтів із НКР.
3. Емболізація та встановлення венозних фільтрів не покращують результатів лікування.
4. Ад’ювантне застосування цитокінів не покращує виживаність пацієнтів після нефректомії.
Лікування при локально-розповсюдженому НКР проводять відповідно до рекомендацій
1. У пацієнтів із клінічно збільшеними лімфовузлами лімфодисекція може бути виконана з метою покращення локального контролю та стадіювання захворювання.
2. Видалення пухлини нирки з пухлинним тромбом нижньої порожнистої вени показане у пацієнтів із локально-розповсюдженим НКР.
3. Згідно з даними контрольованих клінічних досліджень, не існує показань до призначення ад’ювантної системної терапії після оперативного втручання.
Лікування при поширеному та мНКР
Локальна терапія при розповсюдженому/
мНКР: висновки та рекомендації
Нефректомія вражається лікувальною лише за умови повного видалення тканин пухлини. Це включає випадки наявності первинної пухлини та олігометастатичного резектабельного вогнища. Для більшості пацієнтів із метастатичним ураженням циторедуктивна нефректомія залишається паліативним методом та потребує подальшого призначення системної терапії.
Висновки щодо ведення пацієнтів із розповсюдженим/мНКР
1. Циторедуктивна нефректомія в комбінації з інтерфероном (ІФН)-альфа покращує виживаність у пацієнтів із мНКР та задовільним соматичним статусом.
2. Циторедуктивна нефректомія для пацієнтів із симультанною метастазектомією олігометастазів покращує результати лікування та відстрочує початок системної терапії.
3. Усі включені в огляд дослідження були ретроспективними, не рандомізованими, з високим ризиком статистичної похибки та елементами вибірковості.
4. За винятком метастазів у головному мозку, метастазектомія залишається найоптимальнішим методом локальної терапії.
5. Ретроспективні дослідження порівняння свідчать про вищу ефективність виконання повної метастазектомії у контексті загальної та канцерспецифічної виживаності, подовження часу до системної терапії.
6. Радіотерапія кісткових метастазів та метастазів головного мозку у разі НКР може впливати на зменшення вираженості локальної симптоматики.
Лікування при розповсюдженому/мНКР виконують відповідно до рекомендацій
1. Циторедуктивна нефректомія показана у високоселективних пацієнтів із мНКР.
2. Рішення про видалення віддалених метастазів необхідно приймати індивідуально на основі загального стану пацієнта, ризиків проведення оперативного втручання, бажання пацієнта та наявності альтернативних методик для забезпечення локального контролю.
3. У селективних випадках можливе застосування стереотаксичної променевої терапії, спрямованої на кісткові метастази та метастази головного мозку, з метою зменшення вираженості клінічних проявів захворювання.
Системна терапія
(хіміотерапія, імунотерапія, вакцини)
У зв’язку з тим, що НКР розвивається із проксимальних канальців збиральної системи, цей вид пухлини має високий рівень експресії гена множинної медикаментозної стійкості та його продукту Р-глікопротеїну, що є причиною резистентності до більшості хіміопрепаратів.
Висновки щодо поширеного та мНКР
1. Монотерапія ІФН-альфа поступається за ефективністю таргетній терапії у пацієнтів із мНКР.
2. Інтерлейкін (ІЛ)-2 має більше побічних реакцій, ніж ІФН-альфа.
3. Застосування ІЛ-2 у високих дозах має повну відповідь лише у незначної кількості пацієнтів. Однак не існує біомаркерів або клінічних показників, які б могли виділити пацієнтів, у яких ІЛ-2 мали стійку лікувальну дію.
4. Поєднане застосування бевацизумабу + ІФН-альфа більш ефективне, ніж ІФН-альфа у пацієнтів із мНКР, які не проходили жодного лікування, з пухлинами низького та помірного ризику.
5. Вакцинотерапія з пухлинним антигеном 5Т4 не показала переваги щодо виживаності порівняно з першою лінією таргетної терапії.
6. Комбінація цитокінів з/без додавання хіміотерапії не покращує загальної виживаності порівняно з монотерапією.
Лікування при розповсюдженому та мНКР виконують відповідно до рекомендацій
1. Хіміотерапія як монотерапія у хворих на мНКР — неефективний метод лікування.
2. Монотерапію ІФН-альфа або високими дозами ІЛ-2 не застосовують рутинно як першу лінію терапії при мНКР.
Таргетна терапія
При спорадичних формах світлоклітинного НКР відбувається інактивація фактора, індукованого гіпоксією (HIF), що призводить до експресії рецепторів фактора росту ендотелію (VEGFR) та фактора росту тромбоцитів (PDGFR), які ініціюють неоангіогенез. Цей процес істотно впливає на розвиток та прогресію НКР. Деякі таргетні препарати схвалені для застосування при мНКР у США, Європі та Україні:
- Сорафеніб
- Сунітиніб
- Бевацизумаб + ІФН-альфа
- Пазопаніб
- Еверолімус
- Акситиніб
Більшість опублікованих клінічних досліджень проведено для світлоклітинного варіанта НКР, тому немає чітких рекомендацій щодо несвітлоклітинних варіантів. У більшості досліджень, спрямованих на реєстрацію схвалених таргетних агентів, хворі були стратифіковані за ризиком, відповідно до шкали MSKCC (Memorial Sloan Kettering Cancer Center). З часу розробки критеріїв Моцера в еру цитокінів, Міжнародним консорціумом щодо метастичного нирково-клітинного раку (IMDC) розроблено модель ризиків, що оцінена для більш точного прогнозу пацієнтів із мНКР, які отримують лікування в еру таргетної терапії.
Інгібітори тирозинкінази
Сорафеніб — пероральний мультикіназний інгібітор з активністю, спрямованою проти Raf-1серин/треонінкіназ, D-Raf, VEGFR-2, PDGFR, FLT-3 та с-КІТ. Існують дані, що порівняно із сорафенібом із плацебо після невдалої імунотерапії сорафеніб зумовлює покращення показника без прогресивної виживаності (р<0,01). Загальна виживаність поліпшилася у хворих, які перейшли з групи плацебо до групи сорафенібу. У пацієнтів із попередньо нелікованим мНКР сорафеніб не кращий за ІФН-альфа.
Сунітиніб — пероральний інгібітор тирозинкінази (ТКі), що зумовлює протипухлинну та антиангіогенну активність. Як препарат другої лінії монотерапії показує часткову ефективність у 34–40% випадків та стабілізує захворювання >3 міс у 27–29% пацієнтів із мНКР. Застосування препарату в першій лінії монотерапії показало триваліший період безрецидивної виживаності порівняно з ІФН-альфа. Загальна виживаність була вищою для пацієнтів, які отримували сунітиніб впродовж 26,4 та 21,8 міс, незважаючи на кросовер (зміну групи лікування). Рекомендований режим прийом сунітинібу в дозі 50 мг протягом 4 тиж із перервою у прийомі на 14 днів. Альтернативний режим 2-тижневого прийому препарату з подальшим тижнем без препарату застосовують при високій токсичності препарату.
Пазопаніб — пероральний інгібітор ангіогенезу. У дослідженні ефективності пазопаніб порівнювали з плацебо у пацієнтів із нелікованим мНКР і пацієнтів, які отримували цитокіни. При порівнянні ефективності пазопанібу та сунітинібу встановлено, що пазопаніб краще застосовувати як препарат вибору першої лінії терапії. Він не погіршував показники без прогресивної та загальної виживаності пацієнтів порівняно із сунітинібом. Препарати мають дещо різні профілі токсичності, але кращими показники якості життя були у групі пазопанібу.
Акситініб — пероральний селективний інгібітор VEGFR-1, -2 та -3 другого покоління. Існують дані, що загальна медіана безпрогресивної виживаності була більшою у акситинібу, ніж сорафенібу. Найбільшу різницю цього показника відзначено у пацієнтів після неуспішної терапії цитокінами. Акситиніб мав токсичність >3-го ступеня, що проявлялася у вигляді діареї в 11% випадків, гіпертензії — у 16% та знесилення — в 11%. Нудоту відзначали у 32% випадків, блювання — у 24%, астенію — у 21%. Загальна виживаність, оцінювана без кросовера, свідчила про відсутність статистично достовірної різниці серед досліджуваних груп. Акситиніб не застосовують як препарат першої лінії терапії при мНКР.
Моноклональні антитіла проти циркулюючого VEGFR
Бевацизумаб — це гуманізоване моноклональне антитіло. Існують дані щодо вищих показників медіани періоду без прогресивної виживаності для групи з комбінованим лікуванням бевацизумабом + ІФН-альфа проти монотерапії ІФН-альфа. Загальний рівень відповіді на лікування також був вищим у групі комбінованого лікування.
Інгібітори мТОR
Еверолімус — пероральний інгібітор мішені рапаміцину ссавців (mTOR). Існують дані порівняння сунітинібу проти еверолімусу у нелікованих пацієнтів, що супроводжувалося зміною лікування на сунітиніб або еверолімус при прогресуванні, які демонструють більш високу медіану періоду без прогресивної виживаності для першої лінії лікування сунітинібом. Показники виживаності в послідовності сунітиніб — еверолімус високі, але остаточний аналіз ще не завершений. Рекомендації Європейської асоціації урологів (ЄАУ) щодо системної терапії пацієнтів із мНКР наведено у табл. 2.
| Варіант НКР | Група ризику за MSKCC-критерієм | Перша лінія | РД^ | Друга лінія* | РД^ | Третя лінія* | РД | Наступні лінії | РД |
|---|---|---|---|---|---|---|---|---|---|
| Світлоклітинний* | Сприятливий
Помірний |
Сунітиніб
Пазопаніб Бевацизумаб + ІФН-альфа |
1б
1б 1б |
Після ТКі:
– акситиніб – сорафеніб – еверолімус Після цитокінів: – сорафеніб# – акситиніб – пазопаніб |
2а 2а 2а
1б 2а 2а |
Після ТКі:
еверолімус Після мTOR: сорафеніб |
2а
1б |
Будь-який таргетний агент | 4 |
| Світлоклітинний* | Несприятливий** | Темзиролімус | 1б | Будь-який таргетний агент | 4 | ||||
| Несвітлоклітинний§ | Будь-який | Сунітиніб
Еверолімус Темзиролімус |
2а
2б 2б |
Будь-який таргетний агент | 4 |
Висновки щодо системної терапії мНКР
1. ТКі підвищують показник безпрогресивної виживаності та/чи загальної виживаності пацієнтів як перша та друга лінія лікування світлоклітинного варіанта мНКР.
2. Акситиніб показав ефективність та перевагу в безпрогресивній виживаності як друга лінія терапії після прогресуванні на цитокінах та ТКі порівняно із сорафенібом.
3. Сунітиніб ефективніший, ніж ІФН-альфа, у нелікованих пацієнтів.
4. Поєднане застосування бевацизумабу + ІФН-альфа — ефективніше, ніж ІФН-альфа, у нелікованих пацієнтів сприятливої та помірної групи ризику.
5. Пазопаніб має перевагу над плацебо як у нелікованих, так і у пацієнтів із мНКР після лікування цитокінами.
6. Ефективність пазопанібу не нижча, ніж у сунітинібу, в лікуванні світлоклітинного варіанта мНКР.
7. Еверолімус збільшує період безпрогресивної виживаності хворих, які прогресували або інтолерантні до ТКі.
8. Сорафеніб виявляє широку активність у спектрі лікування пацієнтів зі світлоклітинним НКР, які отримували цитокіни або таргетні препарати.
9. Інгібітор мTOR (еверолімус) і ТКі-спрямовані препарати (сунітиніб та сорафеніб) можна застосовувати у разі несвітлоклітинного варіанта НКР.
10. Не існує комбінації препаратів, яка б довела свою перевагу над монотерапією одним агентом.
Системну терапію мНКР виконують відповідно до рекомендацій
1. Системна терапія мНКР має базуватися на таргетних агентах.
2. Сунітиніб та пазопаніб рекомендують як першу лінію терапії для поширеного/метастатичного світлоклітинного НКР.
3. Поєднане застосування бевацизумабу + ІФН-альфа рекомендоване як перша лінія терапії для поширеного/метастатичного світлоклітинного НКР у групах сприятливого та помірного ризику.
4. Акситиніб рекомендований як препарат другої лінії терапії для пацієнтів із мНКР.
5. Еверолімус рекомендований для світлоклітинного варіанта НКР пацієнтам, які прогресували після застосування інгібіторів ТКі.
6. Пазопаніб та сорафеніб — альтернативи акситинібу і рекомендовані як друга лінія терапії пацієнтам, які прогресували після застосування цитокінів.
7. Чергування препаратів рекомендується.
8. Сунітиніб може бути рекомендовано як першу лінію терапії для несвітлоклітинного варіанта мНКР.
9. Проведення таргетної терапії в неоад’ювантному режимі у хворих на локально-розповсюджений НКР може зумовити зниження стадії пухлини, локалізувати її при поширеному процесі, що дасть можливість радикального хірургічного лікування.
10. Проведення таргетної терапії в неоад’ювантному режимі у хворих на локалізований НКР може зумовити зменшення розміру пухлини, що дозволить провести резекцію нирки.
Променева терапія
Симптоматичну променеву терапію застосовують із метою зменшення вираженості больового синдрому в пацієнтів із неоперабельними кістковими метастазами чи метастазами в головний мозок, які не реагують на проведену консервативну терапію (табл. 3).
| Вид лікування | Доза, Гр | |
|---|---|---|
| загальна | разова | |
| Променева терапія при одиничному метастазі в хребці (однократно) | 8 | 8 |
| Променева терапія на метастази у кістках | 35–40 | Щоденно 3 |
| Променева терапія на метастази в головному мозку | До 30 | Щоденно 2,0–2,2–3 |
Протипоказання:
а) відсутність морфологічного підтвердження діагнозу;
б) розпад пухлини з масивною кровотечею;
в) загальні протипоказання до променевої терапії.
Дії лікаря
Методи лікування
а) Хірургічні
1. Відкрита чи лапароскопічна резекція нирки.
2. Відкрита чи лапароскопічна нефректомія.
3. Видалення локального рецидиву чи солітарного метастазу.
б) Променева терапія на метастатичні вогнища
в) Консервативне лікування
1. Системна терапія.
2. Симптоматична терапія.
Виписка з рекомендаціями на післягоспітальний період
При виписці пацієнта надається виписка з медичної карти стаціонарного хворого встановленої форми, яка містить інформацію про отримане лікування, особливості перебігу захворювання, рекомендації щодо подальшого лікування та спостереження.
Виписка пацієнта планується відповідно до критеріїв
1. Завершення запланованого об’єму терапії.
2. Відсутність ускладнень терапії, що потребують лікування у стаціонарі.
3. Неможливість продовження спеціальної терапії у зв’язку з розвитком протипоказань.
При виписці необхідно рекомендувати:
- Спостереження онколога, уролога, сімейного лікаря за місцем проживання.
- Уникати надмірного фізичного навантаження.
- Проведення подальшої терапії чи симптоматичного лікування за місцем проживання.
Критерії виписки
- Завершення обсягу запланованого лікування.
- Відсутність ускладнень тяжкого ступеня.
- Надання рекомендацій стосовно подальшої тактики лікування.
Дії лікаря
1. Оформити Виписку із медичної карти амбулаторного (стаціонарного) хворого (форма № 027/о).
2. Надати пацієнтам, які перенесли спеціальне лікування, інформацію про можливі віддалені побічні ефекти лікування, необхідність проведення періодичних обстежень відповідно до плану диспансеризації.
3. Надати рекомендації щодо способу життя, режиму харчування та фізичних навантажень.
Реабілітація
При виписці пацієнту надається виписка з медичної карти стаціонарного хворого встановленої форми, яка містить інформацію про отримане лікування, особливості перебігу захворювання, рекомендації щодо подальшого лікування, спостереження та реабілітації.
1. Відсутність ускладнень терапії, що потребують лікування у стаціонарі.
2. За необхідності — санаторно-курортне лікування мінеральними водами при стабільному стані пацієнта після завершення лікування в місцевих санаторіях загального профілю.
Дії лікаря
Обов’язкові
Психологічна реабілітація.
Бажані
Надання рекомендацій та/чи протипоказань щодо проведення санаторно-курортного лікування (враховуючи методи та обсяг лікування, стан хворого та результати його обстежень).
Диспансерне спостереження
У зв’язку з небезпекою виникнення рецидиву та/чи метастазів хворі на НКР підлягають диспансерному спостереженню із плановими оглядами в закладі спеціалізованої допомоги, в якому отримували лікування чи за місцем реєстрації.
Спостереження після радикального лікування НКР дає можливість онкологу, урологу моніторувати чи виявляти:
- післяопераційні ускладнення;
- функцію нирок;
- локальний рецидив після резекції нирки чи абляційної терапії;
- метастаз у контралатеральній нирці;
появу віддалених метастазів.
Післяопераційний нагляд — важлива складова, яка додає інформацію про перебіг НКР та має бути виконана урологом, який повинен чітко констатувати час рецидиву або розвитку метастазів. Післяопераційні ускладнення і ниркова функція легко оцінюються на основі історії хвороби, скарг пацієнта, фізикального обстеження та визначення креатиніну сироватки крові чи рівня швидкості клубочкової фільтрації.
Динамічне спостереження має на меті, перш за все, визначення наявності місцевого рецидиву або метастазів на ранній стадії. При метастатичному захворюванні більше поширення пухлини може обмежити можливість хірургічного лікування, яке є стандартом при виявленні резектабельних, особливо солітарних метастазів. До того ж рання діагностика рецидивів може позитивно впливати на ефективність системної терапії, якщо пухлинне ураження не сильно розповсюджене.
Чутливість рентгенографії органів грудної порожнини для дрібних метастазів досить низька, а УЗД недостатньо інформативне. Спостереження не має бути засноване на цих методах візуалізації. При пухлинах із низьким ризиком інтервали спостереження повинні бути адаптовані відносно дози опромінення та діагностичної вигоди. Для зменшення радіаційного опромінення може бути використана МРТ.
При пухлинах середнього чи високого ризику рецидиву слід використовувати КТ грудної клітки та черевної порожнини, незважаючи на значні ризики, пов’язані з опроміненням, які слід враховувати при повторних КТ.
Динамічний нагляд має також включати клінічну оцінку функції нирок та серцево-судинної системи.
Позитронно-емісійна томографія (ПЕТ) і ПЕТ-КТ, а також остеосцинтиграфія скелета не є стандартом динамічного нагляду при НКР у зв’язку з обмеженою специфічністю і чутливістю.
В останні роки розроблено та перевірено на великих групах хворих післяопераційні прогностичні системи та номограми, що комбінують незалежні прогностичні фактори. Ці системи можуть бути більш точними у прогностичному відношенні, ніж класифікація TNM чи градація за Фурманом для розрахунку виживаності при НКР. Вагомою ознакою номограм є можливість підрахунку точності прогнозу, що дає об’єктивну інформацію за всіма новими параметрами. Зараз розроблено декілька нових доопераційних номограм із високою точністю прогнозу, однак вони не рекомендуються як стандарт.
Американською асоціацією клінічних онкологів запропоновано номограму, точність якої становить 86,3%. Суть визначення виживаності полягає в тому, що на номограмі проводиться перпендикулярна лінія від показника по кожному пункту (T, N, M і т.д.) до відповідного показника балів. Перпендикулярна лінія, проведена від загальної суми балів, набраних по кожному пункту, до показника виживаності, відповідає показнику виживаності у кожного конкретного хворого (рис. 9).

ЄАУ запропоновані номограми, які наведено в табл. 4–5.
| Параметр | Бали |
|---|---|
| Розподіл згідно з первинною пухлиною — категорія Т
Т1а рТ1b рТ2 рТ3–рТ4 |
0 2 3 4 |
| Розмір пухлини
<10 см <10 см |
0 1 |
| Статус регіонарних лімфатичних вузлів
pNx/pNo pN1–pN2 |
0 2 |
| Ступінь ядерної атипії
1–2 3 4 |
0 1 3 |
| Некрози пухлини
Немає Наявні |
0 1 |
| Ризик | 1 рік | 3 роки | 5 років | 10 років |
|---|---|---|---|---|
| Низький | 0,5 | 2,1 | 2,9 | 7,5 |
| Середній | 9,6 | 20,2 | 26,2 | 35,7 |
| Високий | 42,3 | 62,9 | 68,8 | 76,4 |
Розрізняють групи низького — 0–2 бали, помірного — 3–5 балів та високого — більше 6 балів ризику виникнення рецидиву.
Алгоритм динамічного нагляду пацієнтів після лікування НКР необхідний, але він має базуватися не лише на профілі ризику пацієнта, але й на ефективності лікування (табл. 6).
| Група ризику | Лікування | Період спостереження, років | ||||||
|---|---|---|---|---|---|---|---|---|
| ½ | 1 | 2 | 3 | 4 | 5 | >5 | ||
| Низький | Тільки НЕ/РН | УЗД | СКТ | УЗД | СКТ | УЗД | СКТ | Не проводиться |
| Помірний | НЕ/РН/кріо/РЧА | СКТ | СКТ | СКТ | УЗД | СКТ | СКТ | СКТ 1 раз на 2 роки |
| Високий | НЕ/РН/кріо/РЧА | СКТ | СКТ | СКТ | СКТ | СКТ | СКТ | СКТ 1 раз на 2 роки |
Дії лікаря
Забезпечити ведення Реєстраційної карти хворого на злоякісне новоутворення (форма №030-6/о) та відображення в ній заходів щодо диспансеризації.
Використана література
- Міністерство охорони здоров’я України (2016) Наказ МОЗ України від 28.03.2016 р. № 247 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при раку нирки».





