Вступ
Визначення інсулінорезистентності (ІР) у пацієнтів кардіоваскулярного профілю є актуальним, оскільки наявність цього стану асоціюється не тільки зі зростанням ризику розвитку цукрового діабету (ЦД) 2-го типу, але і з підвищеним ризиком серцево-судинних ускладнень (Stafie C., 2009; Mohan M. еt al., 2014). Зв’язок між ІР та клінічним прогнозом встановлено не лише у хворих з артеріальною гіпертензією, ожирінням та метаболічним синдромом, а й у осіб із систолічною дисфункцією лівого шлуночка (ЛШ) незалежно від ґенезу останньої (Ingelsson E. et. al., 2005; Sharma A.M., Chetty V.T., 2005; Novo G. et al., 2014; Pucci G. et al., 2014).
У деяких дослідженнях виявлено факт наявності феномену ІР у значної частини пацієнтів (30–49%) із хронічною серцевою недостатністю (ХСН) (Kostis J.B., Sanders M., 2005; Uriel N. et al., 2013). Дедалі більше дослідників розглядають синдром серцевої недостатності як потенційно «інсулінорезистентний стан» (Witteles R.M., Fowler M.B., 2008; Sacca L., 2009).
Синдром серцевої недостатності через підвищення активності ренін-ангіотензин-альдостеронової системи та симпато-адреналової системи, ендотеліальну дисфункцію спричиняє зменшення можливостей регуляції та погіршення периферичного кровотоку. Ці аспекти розглядають як один із можливих чинників погіршення чутливості периферичних тканин (насамперед скелетних м’язів) до інсуліну (Katz S.D. et al., 1992; Morgan D.R. et al., 2004; Kim F. et al., 2008; Barrett E.J. et al., 2009). При цьому підвищення рівня прозапальних цитокінів та системний оксидативний стрес, які притаманні ХСН, виступають факторами інгібування специфічних внутрішньоклітинних білків-транспортерів глюкози (GLUT-4), що може бути чинником ІР (Bryant N.J. et al., 2002; Doehner W. et al., 2010).
На відміну від пацієнтів із метаболічним синдромом і ЦД 2-го типу, причини та фактори, асоційовані з ІР у пацієнтів із ХСН, майже не вивчені.
Мета роботи — визначення предикторів ІР у хворих на ХСН на основі оцінки широкого спектра клініко-демографічних, інструментальних та лабораторних показників.
Об’єкт і методи дослідження
У дослідженні взяли участь 107 пацієнтів із ХСН ІІ–ІV класу за класифікацією Нью-Йоркської кардіологічної асоціації (New York Heart Association — NYHA) із систолічною дисфункцією ЛШ (фракцією викиду ЛШ ≤40%) без ЦД (94 чоловіки, 13 жінок, середній вік — 60 років, стандартне відхилення (СВ) — 11,3 року), з них 84 пацієнти з ішемічною хворобою серця, 23 — з дилатаційною кардіоміопатією. До фрагмента роботи із пробою гіперемії увійшли 83 пацієнти, оскільки інші за клінічними показаннями приймали нітрати тривалої дії.
У групу динамічного спостереження увійшли 23 пацієнти з ХСН, яких спостерігали протягом 3 міс із відповідним «титруванням вгору» нейрогуморальних антагоністів. Впродовж спостереження пацієнти дотримувалися відповідних рекомендацій щодо питного режиму, дієти, способу життя та самодогляду.
Клінічний діагноз встановлювали на підставі результатів клініко-інструментального обстеження із проведенням загальних клінічних досліджень, електрокардіографії, ехокардіографії, рентгенологічного дослідження органів грудної клітки. Індекс маси тіла розраховували у пацієнтів із ХСН після досягнення еуволемічного стану.
У дослідження не включали хворих віком старше 75 років та курців. Також причинами відсторонення від подальшого дослідження були наявність в анамнезі:
- набутих та/чи природжених вад серця;
- інфаркту міокарда давністю до 6 міс;
- мозкового інсульту давністю до 6 міс;
- тромбоемболії гілок легеневої артерії (ЛА) давністю до 6 міс;
- ЦД 1-го та 2-го типу;
- запальних уражень серця;
- термінальної стадії ниркової чи печінкової недостатності;
- бронхіальної астми;
- хронічної обструктивної хвороби легень ІІІ–ІV стадії;
- онкологічних та інфекційних захворювань.
Пацієнтам із ХСН проводили стандартну терапію згідно з чинними національними рекомендаціями (Асоціація кардіологів України, Українська асоціація фахівців з серцевої недостатності, 2012).
Стан чутливості до інсуліну оцінювали з використанням розрахункового індексу НОМА-IR (Homeostasis Model Assessment of Insulin Resistance) за формулою D. Matthews та співавторів (1985):
НОМА-IR = глюкоза натще (ммоль/л) ● інсулін натще (мкОд/мл)/22,5.
Саме зазначений індекс є найбільш широко застосовуваним із відповідною метою (Скибчик В.A., 2006). Чим вищий індекс НОМА-IR, тим нижча чутливість до інсуліну і вища ІР. За критерій ІР слугувала величина індексу НОМА-IR≥2,77 згідно з чинними національними рекомендаціями (Мітченко О.І., Корпачев В.В., 2009). Інсулін, гормони жирової тканини та фактор некрозу пухлини (tumor necrosis factor — (TNF)-α) визначали методом імуноферментного аналізу за допомогою автоматичного аналізатора «IEMS LabSystems» (Фінляндія) з використанням спеціальних тест-систем: «DRG Diagnostics», Німеччина (інсулін), «DRG Diagnostic», Німеччина (лептин), «ASSAYPRO», США (адипонектин), ТОВ «Протеїновий контур», Росія (TNF-α). Рівні глюкози, сечової кислоти, ліпідів у плазмі крові визначали автоматичним біохімічним аналізатором «А 25» («Biosystems», Іспанія).
Ехокардіографічне дослідження проводили на апараті «Medison SonoAce 9900» («SamsungMedison», Республіка Корея). Визначали такi параметри: кінцево-систолічний та кінцево-діастолічний об’єм ЛШ, фракцію викиду ЛШ, кінцево-систолічний та кінцево-діастолічний розмір, товщину задньої стінки ЛШ і міжшлуночкової перетинки та розраховували масу міокарда ЛШ з використанням формули PеnnConvention. Також вимірювали розміри лівого передсердя, правого шлуночка, визначали середній тиск в легеневій артерії (Рсер.ЛА) (Асоціація кардіологів України, Всеукраїнська асоціація фахівців з ехокардіографії, 2013).
Ультразвукове дослідження вазодилатуючої функції ендотелію плечової артерії (ПА) проводили у режимi двовимiрного ультразвукового сканування на апараті «SIEMENS Sonoline Omnia» (Німеччина) з лінійним датчиком, що вимірює в частотному діапазоні 7 МГц. Фiксували змiни дiаметра ПА у вiдповiдь на збільшений потік кровi при проведеннi проби з реактивною гiперемiєю (потікзалежна реакцiя) (Лелюк В.Г., Лелюк С.Е., 2003). Дослiдження розпочинали пiсля 10-хвилинного перебування пацiєнта у горизонтальному положеннi. У ході дослiдження дiаметр ПА вимiрювали у станi спокою, потiм навколо плеча накладали манжету сфiгмоманометра дистальнiше досліджуваної ділянки, нагнітали її на 50 мм рт. ст. більше від вихідного рівня систолічного артеріального тиску (САТ). Тривалiсть фази оклюзiї становила 5 хв. Через 90 с пiсля зняття манжети вимiрювали дiаметр ПА. Вимiрювання проводили лiнiйним методом, який полягає у визначенні дiаметра артерiї з використанням двох точок, встановлених ультразвуковим курсивом. Перша точка знаходилася на межі «адвентиція — медiа» передньої стiнки; друга — на межі «медіа — адвентицiя» задньої стiнки судини. За дiаметр ПА брали середню величину, обчислену в трьох серцевих циклах у дiастолу. Розраховували потікзалежну дилатацію, яка дорівнює вiдношенню змiни дiаметра ПА протягом реактивної гiперемії до дiаметра артерiї в станi спокою, вираженому у вiдсотках до вихідного дiаметра. Нормальною реакцією ПА вважали її дилатацію, яка перевищувала 10% вихідного діаметра. Менше її значення чи вазоконстрикцію вважали патологічними (Воронков Л.Г. та співавт., 2005).
У всіх пацієнтів розраховували швидкість клубочкової фільтрації за формулою D.W. Cockcroft, M.H. Gault (1976). Обстеження пацієнтів проводили після початкового періоду лікування (1–3 тиж), спрямованого на усунення клінічних ознак декомпенсації.
Статистичну обробку даних проводили з використанням пакета програм «SPSS 13.0». Індекс НОМА-IR перетворено в категоріальний з категоріями «ІР–» та «ІР+». Опис цієї категоріальної шкали наведено у табл. 1.
| Категорія | Індекс НОМА-IR |
|---|---|
| ІР– | <2,77 |
| ІР+ | ≥2,77 |
Далі застосовано кластерний аналіз за двома змінними. За першу змінну взято індекс НОМА-IR і перетворено її у категоріальну (ІР– та ІР+), за другу змінну брали один з усіх можливих кількісних предикторів. За метрику, яка дозволяла оцінити відстань між кластерами, взято статистику χ2, скориговану за допомогою поправки Йєтса. Послідовно вибирали граничне значення і виконували перетворення кількісної змінної у категоріальну за шкалою, наведеною в табл. 2.
| Категорія | Опис категорії |
|---|---|
| Менше або дорівнює граничному значенню | Якщо значення кількісної змінної, що аналізують, менше вибраного на поточному кроці аналізу граничного знання чи дорівнює йому |
| Більше граничного значення | Якщо значення кількісної змінної, що аналізують, більше вибраного на поточному кроці аналізу граничного значення |
Вибір найкращого розподілу даних на два кластери здійснювали за максимальним значенням статистики χ2 з урахуванням експертної оцінки одержаних результатів.
В процесі аналізу дані представлено у вигляді таблиці спряженості (табл. 3).
| Категорії кількісної змінної, що аналізували | ІР | |
|---|---|---|
| ІР– | ІР+ | |
| Менше або дорівнює граничному значенню | a | b |
| Більше граничного значення | c | d |
Обчислювали значення достовірності відмінностей (р) між кластерами та відношення шансів (ВШ) з 95% довірчим інтервалом (ДІ) (Бабич П.Н. та співавт., 2005).
Для оцінки істотності динаміки величини індексу НОМА-IR використовували критерій знакових рангів Вілкоксона. Для оцінки зміни частки ІР-пацієнтів до та після лікування застосовували критерій Мак-Немара. Також використовували такі методи, як точний критерій Фішера, критерій Стьюдента або критерій Манна — Уїтні. Для опису нормально розподілених даних застосовували відповідно середні арифметичні значення і стандартне відхилення, а для ненормально розподілених — медіану, нижній та верхній квартилі.
Результати та їх обговорення
Згідно з результатами кластерного аналізу не виявлено предикативного зв’язку між клініко-демографічними та більшістю ехокардіографічних показників структурно-функціонального стану серця та наявністю ІР. Однак інформативними предикторами ІР у пацієнтів із ХСН, за даними лабораторно-інструментальних досліджень, були: рівні TNF-α >16,48 пг/мл, сечової кислоти >584 мкмоль/л, лептину >2,265 нг/мл, відношення лептин/адипонектин (Л/А) >0,16, Рсер.ЛА >40 мм рт. ст., потікзалежна вазодилататорна відповідь (ПЗВВ) ПА <6,27% (табл. 4).
| Кількісна змінна | Граничне значення | а | b | c | d | χ2 | p | ВШ | Границя 95% ДІ | |
|---|---|---|---|---|---|---|---|---|---|---|
| нижня | верхня | |||||||||
| TNF-α, пг/мл | 16,48 | 52 | 32 | 5 | 12 | 4,822 | 0,028 | 3,900 | 1,257 | 12,102 |
| Сечова кислота, мкмоль/л | 584 | 52 | 26 | 10 | 16 | 5,325 | 0,021 | 3,200 | 1,276 | 8,027 |
| Лептин, нг/мл | 2,265 | 23 | 7 | 39 | 37 | 4,697 | 0,030 | 3,117 | 1,196 | 8,126 |
| Л/А | 0,16 | 20 | 6 | 44 | 40 | 3,958 | 0,047 | 3,030 | 1,106 | 8,302 |
| Рсер.ЛА, мм рт. ст. | 40 | 37 | 16 | 22 | 29 | 6,486 | 0,011 | 3,048 | 1,360 | 6,831 |
| ПЗВВ ПА, % | 6,27 | 16 | 19 | 34 | 14 | 4,335 | 0,037 | 2,884 | 1,160 | 7,171 |
Отримані результати узгоджуються з даними інших дослідників щодо ролі хронічного запалення в розвитку ІР, маркером якого є рівень циркулюючого TNF-α (Safranow K. et al., 2009; Wallace M. et al., 2014), у тому числі з даними поодиноких робіт, що стосуються пацієнтів із ХСН (Wisniacki N. et al., 2005; O’Meara E. et al., 2013).
В експериментальних та клінічних дослідженнях описано зв’язок активності гормонів жирової тканини із підвищенням експресії TNF-α у пацієнтів з ожирінням (Otero M. et al., 2006; Gauthier M.S., Ruderman N.B., 2010; Gomez-Zorita S. et al., 2013). Введення екзогенного TNF-α тваринам може індукувати резистентність до інсуліну, тоді як його нейтралізація може підвищити чутливість до останнього (Witteles R.M., Fowler M.B., 2008). Такі механізми впливу TNF-α здійснює через порушення регуляції генів, відповідальних за біологічну дію інсуліну, підвищення рівня вільних жирних кислот через стимуляцію ліполізу, інгібуючого впливу цього цитокіну на рецептори, що активують проліферацію пероксисом (peroxisome proliferator-activated receptors — PPAR) (Wisniacki N. et al., 2005; Salvadо L. et al., 2014).
Існують дані щодо ролі гіперурикемії у розвитку метаболічного синдрому та її зв’язку із системним хронічним запаленням (Onat A. et al., 2006; Lyngdoh T. et al., 2011), а також того, що вона є маркером системного оксидативного стресу (Leyva F. et al., 1998). Тому оцінка цього показника доречна у контексті патогенетичних механізмів ІР при ХСН (Lainscak M., Anker S.D., 2009).
У проведеному дослідженні підвищення рівня сечової кислоти асоціювалося із предиктивною роллю останньої щодо формування ІР у пацієнтів із ХСН.
На відміну від деяких дослідників (Parsonage W. et al., 2002; Reaven G.M. 2011; Stepien M. et al., 2014), нами не виявлено впливу віку, індексу маси тіла, рівнів САТ та частоти серцевих скорочень (ЧСС), характеру ритму серця, фракції викиду ЛШ, азотвидільної функції нирок, ліпідного обміну у пацієнтів із ХСН на стан чутливості до інсуліну. Однак актуальним для досліджуваних пацієнтів є виявлений зв’язок ІР із гормональним станом жирової тканини, зокрема значеннями лептину та відношенням Л/А (див. табл. 4). Розуміючи всю складність інтерпретування причинно-наслідкових зв’язків, можна припустити, що в розвитку ІР певну роль відіграють такі механізми, як порушення функції ендотелію та зниження кровотоку у скелетних м’язах, а також прямий інгібуючий вплив прозапальних цитокінів (TNF-α) на біологічну дію інсуліну (Hotamisligil G.S. et al., 1994; Kovacs I. et al., 2006; Tsarouhas K. et al., 2011).
У дослідженнях описано зв’язок ендотеліальної дисфункції із погіршенням периферичного кровотоку через відповідне зниження його регуляторних можливостей (Anderson E.A., Mark A.L.,1989; Katz S.D. et al.,1992). Це може бути справедливим і в досліджуваних нами пацієнтів, оскільки шанси на виникнення ІР у хворих, в яких приріст діаметра ПА у фазу реактивної гіперемії становив <6,27%, були втричі вищими (див. табл. 4).
Можливим поясненням зв’язку виникнення ІР і підвищення Рсер.ЛА стосовно патофізіологічних передумов може бути істотне погіршення ендотеліальної функції у хворих із ІР (Cleland S.J. et al., 1998; Cersosimo E., De Fronzo R.A., 2006; Rask-Madsen C., King G.L., 2007). Останнє асоціюється з посиленням констрикторної активності дрібних і середніх гілок системи ЛА (Farrero M. et al., 2014).
Подальший аналіз не виявив впливу фармакологічного лікування досліджуваних із ХСН (застосування/відсутність застосування інгібіторів ангіотензинперетворювального ферменту (іАПФ), блокаторів β-адренорецепторів, антагоністів мінералокортикоїдних рецепторів (АМР), доз зазначених препаратів, а також доз петльових діуретиків) на розвиток ІР (табл. 5).
| Параметр | Індекс НОМА-IR | р* | |
|---|---|---|---|
| <2,77 (n=62) | ≥2,77 (n=45) | ||
| іАПФ, n (%) | 42 (67,7) | 34 (75,6) | 0,399 |
| Блокатори β-адренорецепторів, n (%) | 57 (91,9) | 44 (97,8) | 0,397 |
| АМР, n (%) | 55 (88,7) | 38 (84,4) | 0,570 |
| Івабрадин, n (%) | 7 (11,3) | 6 (13,3) | 0,722 |
| Дигоксин, n (%) | 3 (4,8) | 1 (2,2) | 0,637 |
| Аміодарон, n (%) | 26 (41,9) | 17 (37,8) | 0,694 |
| Статини, n (%) | 33 (53,2) | 27 (60) | 0,590 |
| Діуретики, n (%) | 60 (96,8) | 42 (93,3) | 0,648 |
| Алопуринол, n(%) | 6 (9,7) | 4 (8,9) | 1,000 |
Серед фахівців існує думка щодо потенційної здатності блокаторів β- адренорецепторів із вазодилатуючою дією (карведилол, небіволол) підвищувати чутливість до інсуліну (Kostis J.B., Sanders M., 2005; Kveiborg B. et al., 2006; Kovacić D. et al., 2008). Однак, при порівняльному аналізі індексу НОМА-IR у хворих, які застосовували карведилол та бісопролол, відмінностей не виявлено (табл. 6). Медіана індексу НОМА-IR в групі карведилолу становила 2,45 (НК — 1,56; ВК — 3,24), у групі бісопрололу — 2,79 (НК — 1,60; ВК — 3,57); р=0,633 відповідно.
| Параметр | Група | Статистичні дані | p* | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| N | М | Ме | СВ | Мінімум | Максимум | НК | ВК | |||
| Індекс НОМА-IR | Карведилол | 55 | 3,65 | 2,45 | 4,96 | 0,31 | 26,08 | 1,56 | 3,24 | 0,633 |
| Бісопролол | 46 | 3,40 | 2,79 | 3,95 | 0,54 | 25,1 | 1,60 | 3,57 | ||
Достовірних відмінностей між частками пацієнтів із ХСН, які приймали карведилол або бісопролол, у групах з/без ІР не виявлено (табл. 7).
| Показник | Категорія | Індекс НОМА-IR | p* | |
|---|---|---|---|---|
| <2,77 | ≥2,77 | |||
| Блокаториβ-адренорецепторів | Карведилол, n (%) | 35 (61,4) | 20 (45,5) | 0,158 |
| Бісопролол, n (%) | 22 (38,6) | 24 (54,5) | ||
| Усього, n (%) | 57 (100) | 44 (100) | ||
Одержані дані не дозволяють із достатньою мірою аргументованості вважати «інсулінорезистентний стан» у пацієнтів із ХСН показанням до застосування карведилолу як блокатора β-адренорецепторів 1-го вибору.
Водночас, за даними проспективного 3-місячного спостереження 23 пацієнтів із клінічно-контрольованим «титруванням вгору» нейрогуморальних антагоністів (у тому числі блокаторів β-адренорецепторів до максимально переносимих доз), виявлено достовірне зниження індексу НОМА-IR (рис. 1), причому за рахунок тих хворих, які демонстрували вихідну ІР (рис. 2).
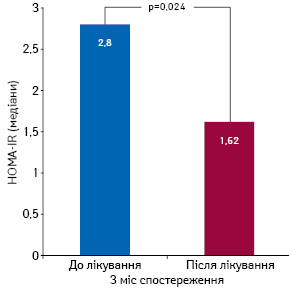
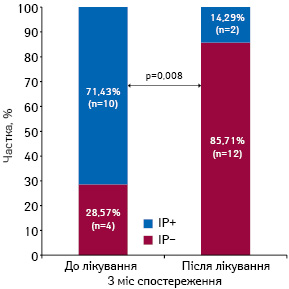
Серед 10 пацієнтів із ІР через 3 міс контрольованого лікування нормалізацію індексу НОМА-IR спостерігали у 8 випадках (див. рис. 2).
Зазначені результати можуть свідчити про те, що провідною передумовою для корекції ІР у хворих на ХСН є, швидше, належне синдромальне лікування серцевої недостатності із титруванням «вгору» нейрогуморальних антагоністів (інгібіторів ренін-ангіотензинової системи, блокаторів β-адренорецепторів) із досягненням стійкої стабілізації клініко-гемодинамічного стану, аніж вибір блокаторів β- адренорецепторів з урахуванням їх додаткових властивостей.
Одержані дані можуть стати основою наступного етапу роботи, спрямованого на дослідження зв’язку ІР з показниками клінічного прогнозу у пацієнтів із ХСН.
Висновки
1. У пацієнтів із ХСН із систолічною дисфункцією ЛШ предикторами ІР є рівні TNF-α (ВШ 3,9; 95% ДІ 1,257–12,102), сечової кислоти (ВШ 3,2; 95% ДІ 1,276–8,027), лептину (ВШ 3,117; 95% ДІ 1,196–8,126), відношення Л/А (ВШ 3,03; 95% ДІ 1,106–8,302), Рсер.ЛА (ВШ 3,048; 95% ДІ 1,360–6,831), ПЗВВ ПА (ВШ 2,884; 95% ДІ 1,160–7,171).
2. Демографічні (вік, стать, етіологія серцевої недостатності), гемодинамічні та інструментальні дані (рівні САТ та ЧСС, характер ритму серця, показники структурно-функціонального стану серця, ліпідний обмін, азотвидільна функція нирок), а також особливості базисного лікування (застосування блокаторів β-адренорецепторів з/без вазодилатуючої функції) не демонструють інформативності щодо розвитку ІР у таких пацієнтів.
3. На фоні 3-місячного проспективного спостереження пацієнтів із ХСН із відповідним «титруванням вгору» нейрогуморальних антагоністів, передбачених стандартною фармакотерапевтичною схемою (іАПФ, блокатори β-адренорецепторів, АМР), до максимально переносимих доз за умови підтримання належного водного балансу спостерігається достовірне зниження індексу НОМА-IR (р=0,024) та збільшення частки хворих із його нормальними значеннями (р=0,008).
Список використаної літератури
-
- Асоціація кардіологів України, Всеукраїнська асоціація фахівців з ехокардіографії (2013) Рекомендації робочої групи з функціональної діагностики (http://www.webcardio.org/Data/Sites/1/lecture/rekomendacii-colichestva.pdf).
- Асоціація кардіологів України, Українська асоціація фахівців з серцевої недостатності (2012) Рекомендації з діагностики та лікування хронічної серцевої недостатності (http://strazhesko.org.ua/upload/2014/02/20/skor-variant-rekomendaciy-2012.pdf).
- Бабич П.Н., Чубенко А.В., Лапач С.Н. (2005) Применение современных статистических методов в практике клинических исследований. Сообщение третье. Отношение шансов: понятие, вычисление и интерпретация. Укр. мед. часопис, 2(46): 113–119 (http://www.umj.com.ua/article/695).
- Воронков Л.Г., Шкурат І.А., Бесага Є.М. (2005) Ендотелійзалежна вазодилатація та її прогностичне значення у хворих з хронічною серцевою недостатністю і систолічною дисфункцією лівого шлуночка. Укр. кардіол. журн., 6: 86–90.
- Лелюк В.Г., Лелюк С.Э. (2003) Ультразвуковая ангиология. Реальное время, Москва, 321 с.
- Мітченко О.І., Корпачев В.В. (2009) Діагностика і лікування метаболічного синдрому, цукрового діабету, предіабету і серцево-судинних захворювань. Метод. рекомендації, Київ, 42 с.
- Скибчик В.А. (2006) Інсулінорезистентність: клінічне значення, методи визначення, підходи до лікування. Укр. мед. часопис, 6(56): 61–68 (http://www.umj.com.ua/article/361).
- Anderson E.A., Mark A.L. (1989) Flow-mediated and reflex changes in large peripheral artery tone in humans. Circulation, 79(1): 93–100.
- Barrett E.J., Eggleston E.M., Inyard A.C. et al. (2009) The vascular actions of insulin control its delivery to muscle and regulate the rate-limiting step in skeletal muscle insulin action. Diabetologia, 52(5): 752–764.
- Bryant N.J., Govers R., James D.E. (2002) Regulated transport of the glucose transporter GLUT4». Nat. Rev. Mol. Cell Biol., 3(4): 267–277.
- Cersosimo E., DeFronzo R.A. (2006) Insulin resistance and endothelial dysfunction: the road map to cardiovascular diseases. Diabetes. Metab. Res. Rev., 22(6): 423–436.
- Cleland S.J., Petrie J.R., Ueda S. et al. (1998) Insulin as a vascular hormone: implications for the pathophysiology of cardiovascular disease. Clin. Exp. Pharmacol. Physiol., 25(3–4): 175–184.
- Cockcroft D.W., Gault M.H. (1976) Prediction of creatinine clearance from serum creatinine. Nephron, 16: 31–41.
- Doehner W., Gathercole D. et al. (2010) Reduced glucose transporter GLUT4 in skeletal muscle predicts insulin resistance in non-diabetic chronic heart failure patients independently of body composition. Int. J. Cardiol., 138(1): 19–24.
- Farrero M., Blanco I., Batlle M. et al. (2014) Pulmonary hypertension is related to peripheral endothelial dysfunction in heart failure with preserved ejection fraction. Circ. Heart Fail., 7(5): 791–798.
- Gauthier M.S., Ruderman N.B. (2010) Adipose tissue inflammation and insulin resistance: all obese humans are not created equal. Biochem. J., 430(2): 1–4.
- Gomez-Zorita S., Fernandez-Quintela A., Lasa A. et al. (2013) Effects of resveratrol on obesity-related inflammation markers in adipose tissue of genetically obese rats. Nutrition, 29(11–12): 1374–1380.
- Hotamisligil G.S., Murray D.L., Choy L.N., Spiegelman B.M. (1994) Tumor necrosis factor alpha inhibits signaling from the insulin receptor. Proc. Natl. Acad. Sci. USA, 91(11): 4854–4858.
- Ingelsson E., Sundström J., Arnlöv J. et al. (2005) Insulin resistance and risk of congestive heart failure. JAMA, 294(3): 334–341.
- Katz S.D., Biasucci L., Sabba C. et al. (1992) Impaired endothelium-mediated vasodilation in the peripheral vasculature of patients with congestive heart failure. J. Am. Coll. Cardiol., 19(5): 918–925.
- Kim F., Pham M., Maloney E. et al. (2008) Vascular inflammation, insulin resistance, and reduced nitric oxide production precede the onset of peripheral insulin resistance. Arterioscler. Thromb. Vasc. Biol., 28(11): 1982–1988.
- Kostis J.B., Sanders M. (2005) The association of heart failure with insulin resistance and the development of type 2 diabetes. Am. J. Hypertens., 18(5): 731–737.
- Kovacić D., Marinsek M., Gobec L. et al. (2008) Effect of selective and non-selective beta-blockers on body weight, insulin resistance and leptin concentration in chronic heart failure. Clin. Res. Cardiol., 97(1): 24–31.
- Kovacs I., Toth J., Tarjan J., Koller A. (2006) Correlation of flow mediated dilation with inflammatory markers in patients with impaired cardiac function. Beneficial effects of inhibition of ACE. Eur. J. Heart Fail., 8: 451–459.
- Kveiborg B., Christiansen B., Major-Petersen A., Torp-Pedersen C. (2006) Metabolic effects of beta-adrenoceptor antagonists with special emphasis on carvedilol. Am. J. Cardiovasc. Drugs, 6(4): 209–217.
- Lainscak M., Anker S.D. (2009) Prognostic factors in chronic heart failure. A review of serum biomarkers, metabolic changes, symptoms, and scoring systems. Herz., 34(2): 141–147.
- Leyva F., Anker S.D., Godsland I.F. et al. (1998) Uric acid in chronic heart failure: a marker of chronic inflammation. Eur. Heart J., 19(12): 1814–1822.
- Lyngdoh T., Marques-Vidal P., Paccaud F. et al. (2011) Elevated serum uric acid is associated with high circulating inflammatory cytokines in the population-based Colaus study. PLoS One, 6(5): e19901.
- Matthews D., Hosker J., Rudenski A. et al. (1985) Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia, 28(7): 412–419.
- Mohan M., Deshmukh H., Maria Choy A., Lang Ch. (2014) Insulin resistance is associated with all-cause mortality and accelerates the risk of progression to diabetes in non diabetic heart failure patients. In: Abstracts of the British Cardiovascular. Society Annual. Conf., June 2–4, Manchester, 34 p.
- Morgan D.R., Dixon L.J., Hanratty C.G. et al. (2004) Impaired endothelium-dependent and -independent vasodilation in elderly patients with chronic heart failure. Eur. J. Heart Fail., 6(7): 901–908.
- Novo G., Pugliesi M., Visconti C. et al. (2014) Early subclinical ventricular dysfunction in patients with insulin resistance. J. Cardiovasc. Med., 15(2): 110–114.
- O’Meara E., de Denus S., Rouleau J.L., Desai A. (2013) Circulating biomarkers in patients with heart failure and preserved ejection fraction. Curr. Heart Fail. Rep., 10(4): 350–358.
- Onat A., Uyarel H., Hergenç G. et al. (2006) Serum uric acid is a determinant of metabolic syndrome in a population-based study. Am. J. Hypertens., 19(10): 1055–1062.
- Otero M., Lago R., Gomez R. et al. (2006) Leptin: a metabolic hormone that functions like a proinflammatory adipokine. Drug News Perspect., 19(1): 21–26.
- Parsonage W., Hetmanski D., Cowley A. (2002) Differentiation of the metabolic and vascular effects of insulin in insulin resistance in patients with chronic heart failure. Am. J. Cardiol., 89(6): 696–703.
- Pucci G., Battista F., de Vuono S. et al. (2014) Pericardial fat, insulin resistance, and left ventricular structure and function in morbid obesity. Nutr. Metab. Cardiovasc. Dis., 24(4): 440–446.
- Rask-Madsen C., King G.L. (2007) Mechanisms of Disease: endothelial dysfunction in insulin resistance and diabetes. Nat. Clin. Pract. Endocrinol. Metab., 3(1): 46–56.
- Reaven G.M. (2011) Insulin resistance: the link between obesity and cardiovascular disease. Med. Clin. North. Am., 95(5): 875–892.
- Sacca Luigi (2009) Heart failure as a multiple hormonal deficiency syndrome. Circ. Heart Fail., 2(2): 151–156.
- Safranow K., Dziedziejko V., Rzeuski R. et al. (2009) Plasma concentrations of TNF-alpha and its soluble receptors sTNFR1 and sTNFR2 in patients with coronary artery disease. Tissue Antigens, 74(5): 386–392.
- Salvadо L., Barroso E., Gоmez-Foix A.M. et al. (2014) PPARβ/δ prevents endoplasmic reticulum stress-associated inflammation and insulin resistance in skeletal muscle cells through an AMPK-dependent mechanism. Diabetologia, 57(10): 2126–2135.
- Sharma A.M., Chetty V.T. (2005) Obesity, hypertension and insulin resistance. Acta Diabetol., 42 (Supp. 1): 3–8.
- Stafie C. (2009) Insulin-resistance diagnosis and its predictive value on cardiovascular diseases and diabetes. Rev. Med. Chir. Soc. Med. Nat. Iasi., 113(1): 64–67.
- Stepien M., Stepien A., Wlazel R.N. et al. (2014) Predictors of insulin resistance in patients with obesity: a pilot study. Angiology, 65(1): 22–30.
- Tsarouhas K., Tsitsimpikou C., Haliassos A. et al. (2011) Study of insulin resistance, TNF-α, total antioxidant capacity and lipid profile in patients with chronic heart failure under exercise. In vivo, 25(6): 1031–1037.
- Uriel N., Gonzalez-Costello J., Mignatti A. et al. (2013) Adrenergic activation, fuel substrate availability, and insulin resistance in patients with congestive heart failure. JACC Heart Fail., 1(4): 331–337.
- Wallace M., Morris C., O’Grada C.M. et al. (2014) Relationship between the lipidome, inflammatory markers and insulin resistance. Mol. Biosyst., 10(6): 1586–1595.
- Wisniacki N., Taylor W., Lye M. (2005) Insulin resistance and inflammatory activation in older patients with systolic and diastolic heart failure. Heart, 91(1): 32–37.
- Witteles R.M., Fowler M.B. (2008) Insulin Insulin-resistant cardiomyopathy clinical evidence, mechanisms, and treatment options. J. Am. Coll. Cardiol., 51: 93–102.
Резюме. Инсулинорезистентность ассоциируется с повышенным риском сердечно-сосудистых осложнений. В отличие от пациентов с метаболическим синдромом и сахарным диабетом 2-го типа, причины и факторы, связанные с инсулинорезистентностью у больных хронической сердечной недостаточностью с систолической дисфункцией левого желудочка, изучены недостаточно.
Ключевые слова: хроническая сердечная недостаточность, инсулинорезистентность, предикторы, блокаторы β- адренорецепторов.
Summary. Insulin resistance is associated with an increased risk of cardiovascular complications. Causes and factors related to insulin resistance in patients with heart failure due to left ventricular dysfunction, unlike patients with metabolic syndrome and diabetes mellitus type 2, haven’t been studied enough.
Key words: chronic heart failure, insulin resistance, predictors, beta-blockers.
Адреса для листування:
Воронков Леонід Георгійович
03151, Київ, вул. Народного ополчення, 5
ННЦ «Інститут кардіології імені академіка
М.Д. Стражеска» НАМН України»,
відділ серцевої недостатності
E-mail: [email protected]





