Традиційно урочисте відкриття і привітання учасників конгресу відбулося під головуванням директора ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», президента Всеукраїнської асоціації ревматологів України, академіка НАМН України, доктора медичних наук, професора Володимира Коваленка. Він зазначив, що конгрес є визначною подією для фахівців різних спеціальностей, оскільки ревматологія є широкою галуззю медицини, в яку залучені не лише лікарі-ревматологи, а й лікарі суміжних спеціальностей, починаючи з фахівців первинної ланки і завершуючи спеціалізованими службами. Сьогодні ревматологія включає >100 нозологічних форм захворювань, які за поширеністю займають 3-тє місце в структурі неінфекційних захворювань, суттєво впливають на працездатність, якість та тривалість життя і несуть значний соціальний тягар. Програма конгресу включила обговорення найактуальніших тем ревматології та внутрішньої медицини, включно з висвітленням мультидисциплінарних питань, які зможуть зацікавити лікарів різних спеціальностей. Конгрес є результатом спільних зусиль провідних вчених нашої країни та науковців EULAR.
Пацієнтоорієнтований підхід при лікуванні запальних артритів
У рамках конгресу відбувся Науково-практичний симпозіум «Пацієнтоорієнтований підхід до лікування запальних артритів», спікерами якого виступили Юлія Білявська, кандидат медичних наук, старший науковий співробітник відділу некоронарних хвороб серця, ревматології та терапії ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, та Олег Яременко, доктор медичних наук, професор, завідувач кафедри внутрішньої медицини № 3 Національного медичного університету імені О.О. Богомольця.

Ю. Білявська присвятила свою доповідь сучасним підходам базисної терапії ревматоїдного артриту (РА) та спондилоартриту (СпА) з позицій викликів клінічної практики, зокрема застосування інгібіторів фактора некрозу пухлини (іФНП). Незважаючи на відмінності в структурі, морфології, фармакологічних властивостях та активності, всі іФНП нейтралізують фактор некрозу пухлини α (ФНП-α), який є ключовим цитокіном в патогенезі РА та СпА, що забезпечує контроль симптомів, сповільнення прогресування і структурних змін захворювання та достовірне покращення якості життя. Однак при їх призначенні важливо розуміти, що всіх представників групи іФНП об’єднує один ключовий недолік — потреба в довготривалому застосуванні.
Відповідно до сучасних гайдлайнів EULAR 2020 р. при лікуванні РА іФНП рекомендовані у 2-й фазі лікування при відсутності відповіді на синтетичні базисні антиревматичні препарати (сБАРП). Як препарати 1-ї лінії іФНП при РА можна призначати за наявності у пацієнта таких несприятливих факторів ризику, як:
- високі рівні серопозитивності (антитіла до циклічного цитрулінованого пептиду+/ревматоїдний фактор+);
- висока активність хвороби (DAS28 ≥5,1);
- ранні деструктивні зміни суглобів (ерозії);
- відсутність відповіді на ≥2 сБАРП [1].
У гайдлайні Американського коледжу ревматології (American College of Rheumatology — ACR) застосування іФНП при терапії СпА рекомендовано фактично як препарати 1-ї лінії у разі відсутності відповіді на нестероїдні протизапальні препарати (НПЗП) та при периферичному атеросклерозі у разі неефективності сБАРП [2]. Сьогодні найпоширенішими препаратами іФНП, які показані для лікування пацієнтів із ревматичними захворюваннями, є адалімумаб, голімумаб, цертолізумаб, інфліксимаб та етанерцепт, які характеризуються різною клінічною ефективністю та розвитком побічних ефектів. Так, результати іспанського реєстру BIOBADASER (2014) продемонстрували, що тривалість ефективної терапії при застосуванні іФНП у пацієнтів зі СпА є суттєво більшою, ніж при РА, і чим довше триває ця схема лікування, тим вища різниця ефективності відмічається [3]. Крім того, результати цього дослідження продемонстрували, що частота побічних явищ при СпА на фоні прийому іФНП є також нижчою порівняно з групою РА. Схожі результати отримані в італійському реєстрі MonitorNet [4]. Враховуючи наявні дані, можна зробити висновок, що тривалість ефективної терапії іФНП є суттєво довшою при СпА порівняно з РА. При цьому різниця збільшується відповідно до тривалості терапії.
О. Яременко у своїй доповіді «Лікування пацієнтів з РА: чи можемо досягти більшого?» приділив увагу сучасним методам лікування РА. За останні десятиліття значно змінилася парадигма лікування РА. Якщо порівняти дані за минулі роки і на сучасному етапі, то ще 30 років тому запалення при РА було вкрай тяжко контролювати, через це у багатьох пацієнтів відмічали значне пошкодження структури, втрату функцій суглобів та їх деформацію [5]. Такі небажані ефекти були пов’язані в першу чергу з відсутністю адекватного лікування захворювання. На сучасному етапі існують препарати, зокрема хворобомодифікуючі антиревматичні препарати (ХМАРП), які окремо або в комбінації дозволяють ефективно контролювати запалення при РА, що забезпечує контроль перебігу захворювання, а в деяких пацієнтів досягнення ремісії.
Зміни в парадигмі лікування РА:
- оптимізація застосування метотрексату;
- розробка надійних інструментів для клінічної оцінки;
- рання діагностика та швидка ініціація ефективного лікування;
- запровадження підходу очікування до досягнення цілі (treat-to-target — T2T);
- поява біологічних ХМАРП та таргетних синтетичних ХМАРП.
Одним із головних напрямків в лікуванні РА на даний час вважається підхід T2T, ключовою метою якого є досягнення клінічної ремісії — відсутність ознак та симптомів значної запальної активності захворювання, яка тісно асоціюється зі структурною ремісією. У той час як клінічна ремісія має бути ключовою в лікуванні, низька активність захворювання може бути альтернативною терапевтичною метою, особливо при довготривалому захворюванні. Відповідно, для прийняття терапевтичних рішень в рутинній клінічній практиці необхідне використання валідованих комплексних інструментів оцінки активності захворювання (табл. 1). Вибір інструмента для оцінки перебігу захворювання та мети лікування може залежати від супутніх захворювань, факторів з боку пацієнта та ризиків, асоційованих з терапією.
Таблиця 1. Критерії активності РА залежно від значень індексів DAS28, CDAI, SDAI
| Критерії активності РА | |||
|---|---|---|---|
| Характеристика | Індекс | ||
| DAS28 | CDAI | SDAI | |
| Ремісія | ≤3,3 | ≤2,8 | ≤2,6 |
| Низька активність захворювання | ≤11 | ≤10 | ≤3,2 |
| Помірна активність захворювання | ≤26 | ≤22 | ≤5,1 |
| Висока активність захворювання | >26 | >22 | >5,1 |
Важливо, щоб оцінка активності захворювання проводилася і документувалася регулярно, на початкових етапах лікування — щомісячно для пацієнтів з високою/помірною активністю РА або менш часто, наприклад, кожні 6 міс, у пацієнтів зі стійкою низькою активністю або ремісією, і залежно від цього змінювати стратегії лікування. При прийнятті клінічних рішень на додаток до комплексної оцінки активності РА необхідно враховувати структурні зміни, функціональне погіршення та супутні захворювання. Окрім того, для досягнення мети лікування важливо, щоб терапія переглядалася кожні 3 міс, а мета лікування — досягнення ремісії — повинна підтримуватися протягом курсу лікування. Ревматолог зобов’язаний інформувати пацієнта про переваги досягнення ремісії включно з покращенням наслідків та зменшенням тягаря супутніх захворювань, а також залучати пацієнта до прийняття клінічних рішень щодо мети та стратегії лікування для кращої прихильності (рис. 1). Таким чином, досягнення ремісії РА — пріоритетна мета лікування, якнайшвидше досягнення якої покращує всі медичні та немедичні наслідки захворювання.

Проблема гіперурикемії та подагри
У межах конгресу відбулася міждисциплінарна дискусія «Гіперурикемія: межі міждисциплінарних повноважень», активну участь в якій взяли провідні вітчизняні експерти в галузі ревматології, кардіології, нефрології та терапії, які розглянули проблему гіперурикемії, як саме вона об’єднує різні спеціальності, основні патогенетичні спільні механізми її дії з формуванням кардіологічних, ревматологічних та загальних терапевтичних захворювань. Очолив проведення дискусії В. Коваленко, який у своєму вступному слові зупинився на інформаційному приводі обговорення гіперурикемії як мультидисциплінарної проблеми та задав тон подальшому обговоренню цього питання.
Ірина Головач, професор, доктор медичних наук, керівник Центру ревматології, у своїй доповіді розкрила проблему гіперурикемії з точки зору загальної коморбідності. Гіперурикемія — лабораторний феномен, який характеризується стійким підвищенням концентрації сечової кислоти (СК) в сироватці крові (максимальна величина до нормального рівня становить 60 мкмоль/л (6 мг/дл) для жінок і 420 мкмоль/л (6,8 мг/дл) для чоловіків (табл. 2). У 2019 р. на Дельфійському голосуванні прийняте визначення «безсимптомна гіперурикемія» — стан, при якому відмічається стійке підвищення рівня СК в сироватці крові вище максимального значення, що не супроводжується симптомами чи патологічними станами, зумовленими відкладенням кристалів СК (наприклад подагра, сечокислий уролітіаз) [6–9].
Визначення, прийняті у Дельфійському голосуванні:
- гіперурикемія без клінічних ознак подагри;
- дані візуалізації депозитів кристалів моноурату натрію (МУН) без клінічних ознак подагри;
- гіперурикемія з даними візуалізації депозитів кристалів МУН без клінічних ознак подагри.
Таблиця 2. Визначення гіперурикемії відповідно до провідних міжнародних ревматологічних товариств
| Визначення гіперурикемії | |||
|---|---|---|---|
| Пороговий рівень для гіперурикемії | Рекомендації | ||
| ACR 2020 | EULAR 2016 | Japanese 2011 | |
| Пороговий рівень для гіперурикемії | 6,8 мг/дл
(404 мкмоль/л) |
6 мг/дл
(360 мкмоль/л) |
7 мг/дл
(420 мкмоль/л) |
СК за рахунок своїх фізико-хімічних властивостей здатна провокувати розвиток запального процесу, активувати синтез імунних медіаторів та ініціювати оксидативний стрес. Зазначені особливості СК створюють умови для розвитку не лише подагри, а й різноманітної коморбідної патології, включно з ішемічною хворобою серця, порушеннями мозкового кровообігу, артеріальною гіпертензією (АГ), метаболічним синдромом та нейродегенеративними захворюваннями. Загальновідомо, що саме СК постає етіологічним фактором розвитку подагри. Відповідно, чим вищим є рівень СК, тим вищий ризик маніфестації з безсимптомної гіперурикемії в симптомну. Однак важливо розуміти, що не завжди гіперурикемія є обов’язково подагрою, оскільки перша є лабораторним феноменом без клінічних симптомів, тоді як подагра — чітко окреслене захворювання з яскравими клінічним перебігом. Інтервал переходу від безсимптомної гіперурикемії до тофусної подагри варіює в межах 3–42 років (у середньому близько 11 років) (рис. 2) [10]. І якщо на сучасному етапі відомо, що подагра є важливим фактором ризику розвитку серцево-судинних, метаболічних та інших захворювань, то інформація про безсимптомну гіперурикемію та фактори її розвитку залишається невизначеною. Дані літератури повідомляють, що ризик загальної смерті та смерті від гіпертрофічної кардіоміопатії залежить від концентрації СК, тобто чим вищий рівень СК в сироватці крові, тим вищий ризик смерті у пацієнта — так званий U-подібний зв’язок [11]. Таким чином, гіперурикемія чинить множинний вплив включно з кардіоваскулярним ризиком, пошкодженням нирок, серцево-судинними порушеннями, та зумовлює розвиток коморбідності (рис. 3).


Неімунологічні ефекти СК:
- у нирках високий рівень СК стимулює РААС, сприяє реабсорбції натрію і збільшує позаклітинний об’єм;
- у поєднанні з гіперактивністю симпатичної нервової системи, яка також стимулюється гіперурикемією, ці зміни призводять до відносно невисокого, але постійного підвищення системного артеріального тиску;
- гіперурикемія також чинить прямий вплив на артеріолярний компартмент, зменшуючи вираженість дії синтази оксиду азоту. Ці модифікації викликають ендотеліальну дисфункцію і сприяють проліферації гладком’язових клітин судин, що призводить до значних артеріолярних змін та гломерулярної гіпертензії (АГ та гіпоксія);
- гіпоксія посилює прямий вплив СК на клітини канальців, підвищує оксидативний стрес і посилює ЕМП, що призводить до фіброзу і пошкодження органів-мішеней (рис. 4).

Імунологічні ефекти СК:
- СК взаємодіє з незрілими дендритними клітинами;
- кристалічна і розчинна СК може інтерналізуватися з обома типами клітин і взаємодіяти з NOD-подібними рецепторами, в кінцевому підсумку активуючи прозапальні цитокіни — інтерлейкін (ІЛ)-1β та ІЛ-18;
- СК також може безпосередньо взаємодіяти з клітинною мембраною, що призводить до залучення та активації Syk-кінази і, в кінцевому підсумку, до активації інфламасоми через рецепторнезалежний механізм;
- СК здатна активувати Toll-подібні рецептори, що призводить до залучення адаптерних білків і запускає каскад кіназ, призводячи до активації NF-kB і секреції прозапальних цитокінів;
- викликаний уратами оксидативний стрес також призводить до продукції неоантигенів, таких як ізолевугландин. Зрілі дендритні клітини мігрують в лімфоїдні органи й активують CD4+ і CD8+, Т-клітини, що призводить до поляризації ТН17 і активації цитотоксичних Т-клітин. Ці активовані Т-клітини мігрують в нирки і підвищують опір судин і реабсорбцію натрію, посилюючи гіпертензію;
- СК також може активувати В-клітини і сприяти їх диференціюванню в продукуючі антитіла плазматичні клітини. Поляризація макрофагів додатково створюється через взаємодію антитіл з їх рецепторами Fcγ; прозапальні макрофаги сприяють фіброзу і ремоделюванню судин. Активація фагоцитів також посилюється за рахунок генерації пов’язаних з гіпертензією молекулярних патернів (DAMP), які можуть запускати Toll-подібні рецептори.
Враховуючи механізми дії СК, можна стверджувати, що гіперурикемія є ключовим фактором у розвитку кардіоренального та метаболічного синдромів, за рахунок її дії на оксидативний стрес, запалення, активацію РААС, ліпогенез та ендотеліальну дисфункцію. Відповідно, перебіг безсимптомної гіперурикемії в подальшому прогресуватиме до подагри, деструктивного ураження суглобів і паралельно з цим прогресуватимуть ниркова недостатність та серцево-судинні захворювання. Саме тому у разі, коли у пацієнта починається симптомна стадія гіперурикемії, у нього також виявляють цілу низку коморбідної патології, що, звичайно, значно ускладнює його менеджмент та потребує вирішення питання не лише терапії суглобового синдрому, а й ниркових, метаболічних та серцево-судинних патологічних станів. Таким чином, на сучасному етапі гіперурикемію розглядають як дуже серйозний складний патологічний стан, який є ключовим компонентом у розвитку кардіоренальної патології.
Погляд нефролога на проблему гіперурикемії представила доцент кафедри нефрології Національного університету охорони здоров’я України імені П.Л. Шупика, кандидат медичних наук Стелла Кушніренко. Вона підкреслила, що при захворюванні нирок завжди виділяли два ключові фактори ризику — АГ та альбумінерію/протеїнурію, однак на сьогодні до них також долучилася гіперурикемія. За останні роки проблема гіперурикемії об’єднала фахівців різних галузей, включно з нефрологами, урологами, кардіологами, ендокринологами та ревматологами, що пов’язано з її асоціацією з кардіоренальною патологією та суглобовим синдромом. На сьогодні нефрологи та урологи виділяють гіперурикемію як ініціатор розвитку хронічної хвороби нирок (ХХН) та драйвер прогресування нефросклерозу (рис. 5) [13].

Дані літератури свідчать, що гіперурикемія відіграє ключову роль у прогресуванні захворювань нирок. Так, результати нещодавнього масштабного італійського дослідження URRAH (n=21963) продемонстрували, що гіперурикемія є фактором ризику серцево-судинної смертності та смертності від усіх причин в доповнення до розрахункової ШКФ (рШКФ) та альбумінурії у пацієнтів із серцево-судинним ризиком [14]. На сучасному етапі гіперурикемію класифікують на симптомну та безсимптомну. І якщо оцінити ці визначення з точки зору фахівців різних медичних галузей, то симптомна гіперурикемія з точки зору лікаря-ревматолога — це подагра, тоді як з точки зору уролога та нефролога вона є сечокам’яною хворобою. Відповідно, ці два різні захворювання мають також різні коди згідно з Міжнародною класифікацією хвороб, що також ускладнює менеджмент пацієнтів із гіперурикемією.
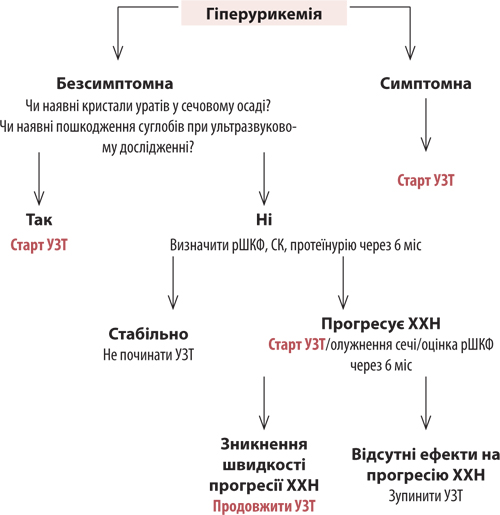
Спікер нагадала, що, окрім визначення рівня СК у сироватці крові, важливо оцінювати СК при 24-годинній екскреції: сироватка крові 119–380 мкмоль/л, сеча — у жінок <4,0 ммоль/л, у чоловіків <5,0 ммоль/л. Сучасні гайдлайни регламентують алгоритм початку призначення уратзнижувальної терапії (УЗТ) з визначення гіперурикемії — симптомна чи безсимптомна та залежно від цього та клінічної картини оцінювати доцільність призначення УЗТ (рис. 6). Симптоматична гіперурикемія є прямим показанням до призначення УЗТ, тоді як виявлення безсимптомної гіперурикемії потребує призначення УЗТ тільки за наявності кристалів уратів у сечовому осаді, ознак ушкодження суглобів при ультразвуковому дослідженні. У випадку якщо зазначені лабораторно-інструментальні дослідження дали негативний результат, рекомендовано через 6 міс оцінити рШКФ, концентрацію СК у сироватці крові та рівень протеїнурії. У разі виявлення лабораторних ознак прогресування ХХН рекомендовано розпочати УЗТ під контролем рШКФ, рівня СК; при зниженні швидкості прогресії ХХН необхідно продовжити УЗТ, а за відсутності впливу на прогресію ХХН — відмінити її.
Еволюція УЗТ починає свій відлік із застосування алопуринолу та індометацину; згодом урикозуричний ефект відзначили в лозартану, фенофібрату, расбурикази. У 2009 р. Управління з контролю за харчовими продуктами і лікарськими засобами США (U.S. Food and Drug Administration — FDA) надало дозвіл на застосування фебуксостату, колхіцину для лікування подагри, а з часом цей перелік доповнили пеглотиказа, анакінра, канакінумаб, топіроксостат, лезинурад. У 2017 р. FDA затвердило застосування алопуринолу та лезинураду при неконтрольованій подагрі. Станом на 2021 р. продовжуються клінічні дослідження щодо оцінки ефективності застосування дотинураду, веринураду та архалофенату при терапії гіперурикемії.
Логічним продовженням міждисциплінарної дискусії став виступ Дмитра Рекалова, професора кафедри внутрішніх хвороб Запорізького державного медичного університету, доктора медичних наук, який у своїй доповіді «Подагра 2021: тектонічний зсув у розумінні…» оцінив проблему менеджменту пацієнтів із гіперурикемією та подагрою з точку зору лікаря-ревматолога. Спікер зазначив, що назва його доповіді незвичайна, оскільки окреслює реальні дані щодо проблеми подагри. Так, в останні роки дійсно відбувся «тектонічний зсув» щодо розуміння подагри та можливостей її терапії, зокрема той факт, що подагра завжди є тофусною. У 2021 р. презентована робота P. Khanna та співавторів, яка продемонструвала, що відкладення кристалів МУН можуть бути виявлені в будь-яких локаціях, включно з ураженням серця, легень, нирок та хребта [15]. Для діагностики тофусів доцільно використовувати двохенергетичну комп’ютерну томографію. Результати цієї роботи підтвердили, що при подагрі завжди є системне ураження з відкладенням МУН у будь-якому органі — тофусна подагра, що потребує міждисциплінарного підходу до менеджменту пацієнтів із цією патологією.
Незважаючи на успіхи сучасної медицини та можливості фармакології, поширеність подагри продовжує неухильно зростати в усьому світі, що асоціюється з ожирінням і метаболічним синдромом. Основні проблеми менеджменту пацієнтів із подагрою пов’язані насамперед з поганою прихильністю до лікування (найнижчі показники тригерного лікування через рік) і клінічною інертністю лікарів (дози УЗТ не титруються) [16]. При менеджменті пацієнтів із подагрою першочерговим є визначення мети лікування — зміна рівнів СК до нормальних значень. Відповідно до гайдлайну міжнародних медичних товариств нормальним рівнем СК вважаються від <5,0 до <6,0 мг/дл або від <300 (для пацієнтів із тяжким перебігом подагри) до <360 ммоль/л (табл. 3). При цьому ще одним проблемним питанням менеджменту подагри є думка пацієнтів про те, що дієтотерапія є найкращим варіантом боротьби з гіперурикемією та подагрою, але це не підтверджено науковими даними. І хоча Британське товариство ревматологів (British Society for Rheumatology — BSR) у своїх рекомендаціях зазначає, що дотримання збалансованого харчування може допомогти знизити рівень СК на 10–12%, однак цей підхід не допоможе контролювати та лікувати захворювання. Клініцист повинен донести до пацієнта, що подагра — генетично зумовлене захворювання, яке потребує міждисциплінарного підходу та призначення адекватної фармакотерапії [17].
Таблиця 3. Нормальні показники СК
| Показники СК | |||
|---|---|---|---|
| Міжнародні товариства | Нормальні показники СК | Коментар | |
| мг/дл | ммоль/л | ||
| ACR | <6,0 | <360 | Мінімальна терапевтична мета лікування |
| Альтернативна мета відсутня | |||
| EULAR | <6,0 | <360 | Мінімальна терапевтична мета/лікувально-профілактична мета |
| <5,0 | <300 | ||
| BSR | ≤5,0 | ≤300 | Мінімальна мета лікування |
| <6,0 | <360 | Профілактична мета лікування | |
Сучасні дані свідчать, що найкращим варіантом лікування подагри є двохступеневий підхід — так звана гіпотеза «брудного посуду». 1-й етап її представлений періодом розчинення кристалів МУН, при цьому цільовий рівень уратів у сироватці крові буде значно нижчим ніж стандартні показники (6 мг/дл) для повного розчинення утворених кристалів. Після цього слідує 2-й етап — період профілактичного лікування, в якому ключовою метою є рівень МУН, трохи нижчий за стандартні показники, для того щоб уникнути утворення нових кристалів (рис. 7) [18].

Згідно з гайдлайном EULAR 2016 р. терапію гострого нападу подагри необхідно розпочинати якомога раніше. Лікувальна тактика залежить від тяжкості захворювання, кількості уражених суглобів і тривалості атаки. Рекомендації передбачають призначення колхіцину, НПЗП, преднізолону, комбіноване застосування зазначених препаратів, а також внутрішньосуглобове введення глюкокортикостероїдів. За наявності протипоказань до призначення колхіцину, НПЗП, глюкокортикостероїдів рекомендується розглянути доцільність застосування блокаторів ІЛ‑1. Спікер також підкреслив, що важливо уникати призначення колхіцину пацієнтам із тяжкою нирковою недостатністю та одночасним прийомом препаратів, що інгібують CYP 3A4 [19]. Існують і розбіжності у підходах до менеджменту подагри серед американських та європейських товариств. Так, відповідно до рекомендацій ACR при терапії гострого нападу подагри рекомендуються колхіцин, НПЗП або глюкокортикостероїди (перорально/внутрішньом’язово або внутрішньосуглобово) як препарати 1-ї лінії, які мають переваги перед інгібіторами ІЛ-1. Таким чином, вибір терапевтичної тактики повинен бути виконаний на основі індивідуальних чинників і переваг для пацієнта.
Список використаної літератури
- 1. Smolen J.S., Landewé R.B.M., Bijlsma J.W.J. et al. (2020) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann. Rheum. Dis., 79(6): 685–699. doi: 10.1136/annrheumdis-2019-216655.
- 2. Ward M.M., Deodhar A., Gensler L.S. et al. (2019) 2019 Update of the American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis Rheumatol., 71(10): 1599–1613. doi: 10.1002/art.41042.
- 3. Carmona L., de la Vega M., Ranza R. et al. (2014) BIOBADASER, BIOBADAMERICA, and BIOBADADERM: safety registers sharing commonalities across diseases and countries. Clin. Exp. Rheumatol., 32(5 Suppl. 85): S-163-7.
- 4. Scirè C.A., Caporali R., Sarzi-Puttini P. et al. (2013) Drug survival of the first course of anti-TNF agents in patients with rheumatoid arthritis and seronegative spondyloarthritis: analysis from the MonitorNet database. Clin. Exp. Rheumatol., 31(6): 857–863.
- 5. Schett G., Emery P., Tanaka Y. et al. (2016) Tapering biologic and conventional DMARD therapy in rheumatoid arthritis: current evidence and future directions. Ann. Rheum. Dis., 75(8): 1428–1437. doi: 10.1136/annrheumdis-2016-209201.
- 6. FitzGerald J.D., Dalbeth N., Mikuls T. et al. (2020) 2020 American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res (Hoboken)., 72(6): 744–760. doi: 10.1002/acr.24180.\7.
- 7. Richette P., Doherty M., Pascual E. et al. (2016) 2016 updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis., 76(1): 29–42. doi: 10.1136/annrheumdis-2016-209707.
- 8. Yamanaka H., Japanese Society of Gout and Nucleic Acid Metabolism (2011) Japanese guideline for the management of hyperuricemia and gout: second edition. Nucleosides Nucleotides Nucleic. Acids, 30(12): 1018–1029. doi: 10.1080/15257770.2011.596496.
- 9. Bursill D., Taylor W.J., Terkeltaub R. et al. (2019) Gout, Hyperuricaemia and Crystal-Associated Disease Network (G-CAN) consensus statement regarding labels and definitions of disease states of gout. Ann. Rheum. Dis., 78(11): 1592–1600. doi: 10.1136/annrheumdis-2019-215933.
- 10. Stamp L., Dalbeth N. (2014) Screening for hyperuricaemia and gout: a perspective and research agenda. Nat. Rev. Rheumatol., 10(12): 752–756. doi: 10.1038/nrrheum.2014.139.
- 11. Cho S.K., Chang Y., Kim I. Et al. (2018) U-Shaped Association Between Serum Uric Acid Level and Risk of Mortality: A Cohort Study. Arthritis Rheumatol., 70(7): 1122–1132. doi: 10.1002/art.40472.
- 12. Ponticelli C., Podestà M.A., Moroni G. (2020) Hyperuricemia as a trigger of immune response in hypertension and chronic kidney disease. Kidney Int., 98(5): 1149–1159. doi: 10.1016/j.kint.2020.05.056.
- 13. Hisatome I., Kuwabara M. (2016) Hyperuricemia Plays Pivotal Role in Progression of Kidney Disease. Circ J., 80(8): 1710–1711. doi: 10.1253/circj.CJ-16-0605.
- 14. Viazzi F., Russo E., Leoncini G. et al. (2021) Serum Uric Acid and Kidney Disease Measures Independently Predict Cardiovascular and Total Mortality: The Uric Acid Right for Heart Health (URRAH) Project. Front. Cardiovasc. Med., 8: 713652. doi: 10.3389/fcvm.2021.713652.
- 15. Khanna P., Johnson R.J., Marder B. et al. (2021) Systemic Urate Deposition: An Unrecognized Complication of Gout? J. Clin. Med., 9(10): 3204. doi: 10.3390/jcm9103204.
- 16. Pascart T., Lioté F. (2019) Gout: state of the art after a decade of developments. Rheumatology (Oxford)., 58(1): 27–44. doi: 10.1093/rheumatology/key002.
- 17. Hui M., Carr A., Cameron S. et al. (2017) The British Society for Rheumatology Guideline for the Management of Gout. Rheumatology (Oxford), 56(7): e1–e20. doi: 10.1093/rheumatology/kex156.
- 18. Perez-Ruiz F., Herrero-Beites A.M., Carmona L. (2011) A two-stage approach to the treatment of hyperuricemia in gout: the «dirty dish» hypothesis. Arthritis Rheum., 63(12): 4002–4006. doi: 10.1002/art.30649.
- 19. Richette P., Doherty M., Pascual E. et al. (2017) 2016 updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis., 76(1): 29–42. doi: 10.1136/annrheumdis-2016-209707.





