 Ревматоїдний артрит (РА) належить до найбільш тяжкої патології опорно-рухового апарату, яка призводить до значущої рухової дисфункції, психологічних проблем та, як наслідок, соціальної дезадаптації пацієнтів. До симптомів РА з домінуючим значенням відносять суглобовий біль, який тривалий час вважали індикатором активності запального процесу. Відповідно до актуальних узагальнених рекомендацій для зменшення вираженості больового синдрому у пацієнтів із РА рекомендовано застосування нестероїдних протизапальних препаратів (НПЗП), механізм дії яких спрямований на зменшення вираженості болю, обумовленого запальним процесом. Однак клінічний досвід свідчить про незадовільний лікувальний ефект від застосування НПЗП у деяких пацієнтів та відсутність кореляції між інтенсивністю больових відчуттів та активністю запального аутоімунного захворювання. На підставі отриманих результатів висунуто припущення щодо змішаного характеру болю у пацієнтів із РА, який виникає у результаті порушення балансу ноцицептивної (запальної) та антиноцептивної (нейропатичної) системи. Сучасний погляд на патофізіологію аутоімунних системних запальних захворювань приділяє увагу формуванню патологічного кола «запалення — біль — запалення», оскільки біль водночас виступає провідним клінічним симптомом та тригером розвитку РА [1].
Ревматоїдний артрит (РА) належить до найбільш тяжкої патології опорно-рухового апарату, яка призводить до значущої рухової дисфункції, психологічних проблем та, як наслідок, соціальної дезадаптації пацієнтів. До симптомів РА з домінуючим значенням відносять суглобовий біль, який тривалий час вважали індикатором активності запального процесу. Відповідно до актуальних узагальнених рекомендацій для зменшення вираженості больового синдрому у пацієнтів із РА рекомендовано застосування нестероїдних протизапальних препаратів (НПЗП), механізм дії яких спрямований на зменшення вираженості болю, обумовленого запальним процесом. Однак клінічний досвід свідчить про незадовільний лікувальний ефект від застосування НПЗП у деяких пацієнтів та відсутність кореляції між інтенсивністю больових відчуттів та активністю запального аутоімунного захворювання. На підставі отриманих результатів висунуто припущення щодо змішаного характеру болю у пацієнтів із РА, який виникає у результаті порушення балансу ноцицептивної (запальної) та антиноцептивної (нейропатичної) системи. Сучасний погляд на патофізіологію аутоімунних системних запальних захворювань приділяє увагу формуванню патологічного кола «запалення — біль — запалення», оскільки біль водночас виступає провідним клінічним симптомом та тригером розвитку РА [1].
Хронічний больовий синдром (ХБС) виникає в результаті постійного больового сигналу з ключових структур антиноцецептивної системи (ростральні вентромедіальні відділи продовгуватого мозку та дорсолатеральні відділи покришки середнього мозку) з подальшим послідовним порушенням балансу ноцицептивної та антиноцицептивної (серотонінергічної та норадреналінергічної) регуляції. У результаті сенситизації центральних та периферичних нейронів до клінічної картини РА додаються тривожно-депресивні симптоми та ознаки хронічного ХБС. Порушення антиноцецептивної системи регуляції болю значно погіршує якість життя пацієнта, збільшує кількість змін препаратів до досягнення терапевтичної мети і знижує частоту задовільної клінічної відповіді на застосування препаратів базисної терапії, особливо біосимілярів.
Згодом виявлено нейрогенні механізми больового відчуття, які виникають під впливом тривалого стресу. На ймовірність виникнення тривожно-депресивних розладів у пацієнтів із РА вказують певні емоційно-особистісні риси характеру та анамнестичні особливості. Враховуючи це, частота виникнення РА виявилася вищою у пацієнтів із порушенням формування прихильності до матері та певним стилем сімейного виховання.
Наразі основною патогенетичною ланкою больового відчуття при РА вважають гіперзбудливість серотонінергічних нейронів емоційних зон гіпоталамусу, зумовлену тривалими негативними емоціями. Порушення проведення та обробки ноцицептивних сигналів призводять до виникнення емоційнозалежного напруження в білясуглобових тканинах та зсуву імунної системи, неконтрольована активація якої призводить до дисбалансу цитокінів та виникнення запалення. Під впливом прозапальних цитокінів інтерлейкіну-1 та фактора некрозу пухлини-α зменшується швидкість зворотного захоплення серотоніну та норадреналіну, що зумовлює зміну нейробіологічних зв’язків та призводить до виникнення нейропатичного болю. Таким чином, посилення ноцицептивного болю нейропатичним компонентом зумовлене ексайтотоксичним ефектом прозапальних цитокінів. Основні етапи формування психосоматичного порушення у жінок із РА показані на рис. 1.

Зважаючи на ключову роль тривалого психічного стресу у патогенезі РА, нейропсихічні розлади відіграють провокативну роль у преморбідній фазі захворювання та змінюють генетично обумовлені патологічні імунні зсуви, які зумовлюють особливості фенотипу та перебігу захворювання. Виникла внаслідок розвиненої форми стресу нейротрансміттерна дисфункція підсилює дезадаптацію пацієнтів із РА і виступає модулятором клінічної відповіді на лікування. Результати досліджень свідчать про вищу частоту та більшу тривалість загострень аутоімунного процесу, збільшення часу досягнення ремісії або субремісії у пацієнтів із депресією. У результаті відмічають посилення фрустраційних настроїв у пацієнтів та підвищення частоти звертання за медичною допомогою. Виокремлення психосоматичних факторів ризику нейропсихічних розладів у пацієнтів із РА сприяло розвитку міждисциплінарного напрямку медицини — нейроревматології, в рамках якої проводиться пошук оптимальних механізм-індукованих підходів до діагностики та лікування пацієнтів із РА [2].
Зважаючи на провідну роль порушення балансу ноцицептивної та антиноцицептивної системи, формування ХБС пов’язане з приєднанням до запального компоненту комбінації негативних (гіпестезія, гіпалгія, гіпалгезія) та позитивних (гіперестезія, гіпералгезія) нейропатичних симптомів. Діагностика нейропатичного болю базується на суто описовій базі. Ефективними інструментами для оцінювання нейропатичного компоненту ХБС можуть стати Лідська шкала оцінювання нейропатичного болю (Leeds assessment of neuropathic symptoms and signs — LANSS) та опитувальник DN4. Поширене застосування опитувальників та шкал зумовлене кількома чинниками, один з яких — простота та ефективність визначення нейропатичного компоненту ХБС. Основними методами виявлення тривожно-депресивних симптомів та стану здоров’я у пацієнтів залишаються шкала Гамільтона (Hamilton Depression Rating Scale — HDRS)-17 та шкала Бека. Спираючись на дані рандомізованих досліджень, виявлено слабку кореляцію інтенсивності больового синдрому з рівнем запальних маркерів крові. Проте інтенсивність ХБС клінічно зумовлена кількістю уражених суглобів, тяжкістю тривожно-депресивних розладів та результатами оцінювання пацієнтом стану свого здоров’я. Дослідження свідчать про негативний вплив на показники якості життя виникнення фіброміалгії внаслідок приєднання нейропатичного компоненту болю [3].
Питання вибору лікувальної стратегії у пацієнтів із ХБС становить певні труднощі. Застосування у пацієнтів із РА та депресивними розладами протисудомних препаратів та антидепресантів з метою зменшення вираженості больового відчуття виправдовує себе незалежно від локалізації болю (спина, кінцівки, внутрішні органи) [4, 5]. Механізм дії численних антидепресантів полягає у регуляції концентрації серотоніну та/або норадреналіну у нейрональних синапсах, яка впливає на регуляцію нисхідних серотонінергічних та норадренергічних антиноцицептивних шляхів. Золотим перерізом позитивного впливу на нейромедіаторний дисбаланс залишається ефективність трициклічних антидепресантів (ТЦА) у пацієнтів із хронічною фіброміалгією та/або симптомами великого депресивного розладу. Однак численні побічні ефекти, пов’язані з неселективним блокуванням рецепторів нейронів, спричинили пошук антидепресантів з селективною дією, один з яких — дулоксетин із групи селективних інгібіторів зворотного захоплення серотоніну та норадреналіну (СІЗЗСН). Дослідження свідчать про вищу ефективність СІЗЗСН порівняно із селективними СІЗЗС завдяки збалансованому впливу на серотонінергічні та норадренергічні нейрони [6]. Статистичний аналіз результатів дослідження свідчить про здатність дулоксетину зменшувати вираженість больових відчуттів у ≥50% пацієнтів незалежно від редукції емоційних порушень [7]. На тлі застосування дулоксетину визначений позитивний вплив на якість життя за шкалою DN4 у пацієнтів з остеоартритом і хронічним вертеброгенним больовим синдромом [8]. Однак найкращі результати отримано у пацієнтів із поєднанням ХБС та депресії.
У 2019 р. опубліковані результати post hoc-аналізу 15 рандомізованих досліджень, в якому порівнювали ефективність тривалого (12 тиж) застосування дулоксетину та плацебо у пацієнтів із депресивними розладами різної тяжкості. Виходячи з базової кількості балів за шкалою HDRS-17 на початку дослідження 21,3 в обох групах, вже наприкінці 1-го тижня виявлено значну перевагу від застосування дулоксетину порівняно з плацебо. У пацієнтів інтервенційної групи спостерігали зменшення вираженості психічного збудження, тривоги та відчуття провини. Позитивні зміни визначалися покращенням настрою та зниженням суїцидальної напруги. Неспівпадіння ключових ознак депресії за шкалою HDRS-17 між двома групами пацієнтів дослідники пов’язали з вищими ризиками виникнення безсоння, сексуальної дисфункції, шлунково-кишкових симптомів та зменшення маси тіла у пацієнтів інтервенційної групи порівняно з групою плацебо [9]. На рис. 2 показано динаміку зміни депресивних симптомів у пацієнтів із ХБС під впливом дулоксетину та плацебо [10].
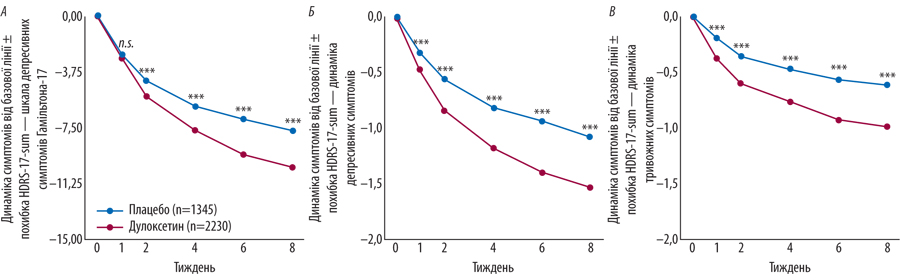
Залишається дискусійним питання щодо ефективності СІЗЗСН у пацієнтів із легкою та помірною тяжкістю депресивних розладів. Близький до плацебо ефект від застосування дулоксетина отриманий в групі пацієнтів з легкими (р=0,11) та помірними (р=0,56) депресивними розладами, або за сумою балів оцінки 6 ключових симптомів депресії (р=0,5). Однак відмінності в дії плацебо та дулоксетину виявилися клінічно значущими у пацієнтів із кількістю балів за шкалою HDRS-17 ≥18, але ≤27, що вказує на великий депресивний розлад [10]. Таким чином, дослідники дійшли висновку щодо найвищої ефективності дуклосетину у пацієнтів із тяжкою депресією.
На противагу загальній ефективності, вплив на нейропсихічну сферу та знеболювальний ефект дулоксетину виявилися вищими порівняно з антидепресантами з групи СІЗЗС та ТЦА. У дослідженні, в якому порівнювали ефекти СІЗЗСН та СІЗЗС, виявлено статистично значущу перевагу знеболювального ефекту від застосування дулоксетину у дозі 60 мг/добу у пацієнтів із діабетичною больовою нейропатією порівняно із застосуванням прегабаліну у дозі 300 мг/добу (р=0,05) [11]. У результаті спостереження за станом пацієнтів з ХБС встановлено, що застосування дулоксетину зумовило зменшення вираженості ХБС у кожного 2-го пацієнта та дорівнювало анальгезивному ефекту від застосування ТЦА (відповідно 2,5 та 2,1 пролікованих пацієнтів, 95% довірчий інтервал (ДІ) 1,9–3,6). Дослідження оптимальної терапевтичної дози для досягнення знеболювального ефекту свідчать, що дулоксетин у дозі 60–120 мг/добу викликав зменшення вираженості больового відчуття у 1 з 5,2 пролікованих пацієнтів (95% ДІ 3,7–5,8) [12]. Отримані переконливі результати зменшення вираженості болю на 30–50% та збільшення рухливості суглобів у результаті застосування дулоксетину у пацієнтів з болем у спині, пов’язаним з остеоартритом та фіброміагією. Покращення якості життя на тлі застосування дулоксетину становило 42–67% у пацієнтів інтервенційної групи порівняно з 26–50% з контрольної [13]. Пероральна форма дулоксетину (Дулоксин®) передбачає можливість скорочення кратності прийому препарату до 1 раза на добу, що значно спрощує режим застосування та формує прихильність пацієнтів до лікування. На думку експертів Європейської федерації неврологічних товариств (European Federation of Neurological Societies — EFNS, 2019) [14], Американського коледжу лікарів (Аmerican Сollege of Рhysicians — АСР, 2020) [15], Європейської ліги ревматологів (European League Against Rheumatism — EULAR, 2017) [16] та Міжнародного дослідницького товариства остеартриту (Osteoarthritis Research Society International — OARSI, 2014) [17], стандартизація застосування дулоксетину у пацієнтів із аутоімунним ураженням опорно-рухового апарату вбачається раціональною дією.
На відміну від опіоїдів та ТЦА, до значних переваг дулоксетину відносять відсутність звикання та необхідності організації постійного спостереження за застосуванням препарату. Серед найбільш частих побічних ефектів від застосування дулоксетину відмічали шлунково-кишкову дисфункцію, яка проявлялася нудотою та блюванням, запором і втратою апетиту. На 2-му місці за частотою — сонливість, сухість у роті та слабкість [18]. Проте відсутність кардіотоксичної дії дозволяє рекомендувати застосування СІЗСН пацієнтам із нейропатичним болем та серцево-судинною коморбідністю. Завдяки мінімальному ризику виникнення синдрому відміни, препарат рекомендовано до застосування в амбулаторних умовах в дозі 60–120 мг/кг маси тіла [19]. На рис. 3 надані результати плацебо-контрольованого дослідження безпеки дулоксетину.

Таким чином, внаслідок змін активності симпатоадреналової системи у пацієнтів із РА в результаті складного патогенезу формується індивідуальний фенотип хронічного болю змішаного характеру. Інтенсивність та перебіг больового синдрому при РА залежать не стільки від активності запального процесу, скільки від впливу рівня тривожності та суб’єктивного визначення інтенсивності болю пацієнтом. Діагностика хронічного больового синдрому базується на суто описовій базі з послідовною консультацією ревматолога, невролога та психотерапевта. Для сучасної терапії ХБС характерна зростаюча роль механізмобумовленого лікування. На відміну від теоретичного припущення відмінної ефективності дулоксетину для лікування депресивного розладу різної тяжкості, СІЗЗСН зарекомендували себе як безпечний засіб для ефективного знеболення та покращення психологічного стану у пацієнтів із хронічним больовим синдромом. Відмова від застосування СІЗЗСН може призвести до негативних соціальних наслідків, пов’язаних із погіршенням якості життя пацієнтів із РА та остеоартритом. Зважений підхід до рекомендацій щодо призначення СІЗЗСН, на думку дослідників, передбачає застосування їх у пацієнтів після визначення фенотипу захворювання.
UA-DULO-PUB-042021-010
Список використаної літератури/References:
- 1. Dworkin R.H., Backonja M., Rowbotham M.C. et al. (2003) Advances in neuropathic pain: diagnosis, mechanisms, and treatment recommendations. Arch. Neurol., 60: 1524–1534. http// doi: 10.1001/archneur.60.11.1524
- 2. Baron R. (2000) Neuropathic pain. The long path from mechanisms to mechanism‐based treatment. Anaesthetist., 49: 373– 386. http//doi: 10.1007/s001010070105
- 3. Hieronymus F., Nilsson S., Eriksson E. (2016) A mega-analysis of fixed-dose trials reveals dose-dependency and a rapid onset of action for the antidepressant effect of three selective serotonin reuptake inhibitors. Transl. Psychiatry, 6: e834. http// doi: 10.1038/tp.2016.104
- 4. Acharya N., Rosen A.S., Polzer J.P. et al. (2006) Duloxetine: meta-analyses of suicidal behaviors and ideation in clinical trials for major depressive disorder. J. Clin. Psychopharmacol., 26: 587–594. doi: 10.1097/01.jcp.0000246216.26400.db
- 5. Perahia D.G., Wang F., Mallinckrodt C.H. et al. (2006) Duloxetine in the treatment of major depressive disorder: a placebo- and paroxetine-controlled trial. Eur. Psychiatry., 21: 367–378. http// doi: 10.1016/j.eurpsy.2006.03.004
- 6. Bagby R.M., Ryder A.G., Schuller D.R. et al. (2004) The Hamilton Depression Rating Scale: has the gold standard become a lead weight? Am. J. Psychiatry, 161: 2163–2177. http// doi: 10.1176/appi.ajp.161.12.2163
- 7. Attala N., Cruccua BG., Barona CR., et al. (2010) EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. European Journal of Neurology (httpp// doi: 10.1111/j.1468-1331.2010.02999.x.).
- 8. Perahia D.G. (2006) Efficacy of duloxetine in painful symptoms: an analgetic or antidepressant effect. Int. Clin. Psychopharmacol. httpp// doi: 10.1097/01.yic.0000224782.83287.3c.
- 9. Smith H.S., Smith E.J., Smith B.R. et al. (2012) Duloxetine in the management of chronic musculoskeletal pain. Ther. Clin. Risk Manag. (httpp// doi: 10.2147/TCRM.S17428).
- 10. Lisinski A., Hieronimus F., Naslund K. et al. (2020) Item-based analysis of the effects of duloxetine in depression: a patient-level post hoc study. Neuropsychopharmacol., 45: 553–560. https://doi.org/10.1038/s41386-019-0523-4
- 11. Tanenberg R.J., Irving G.A., Risser R.C. et al. (2011) Duloxetine, pregabalin, and duloxetine plus gabapentin for diabetic peripheral neuropathic pain management in patients with inadequate pain response to gabapentin: an open-label, randomized, noninferiority comparison. Mayo Clinc. (http//DOI: 10.4065/mcp.2010.0681).
- 12. Goldstein D.J., Lu Y., Detke M.J. et al. (2004) Duloxetine in the treatment of depression: A double-blind placebo-controlled comparison with paroxetine. J. Clin. Psychopharmacology (httpp// doi: 10.1097/01.jcp.0000132448.65972.d9).
- 13. Fava M., Mallinckrodt C.H., Detke M.J. et al. (2004) The effect of duloxetine on painful physical symptoms in depressed patients: Do improvements in these symptoms result in higher remission rates. J. Clin. Psychiatry (http// doi: 10.4088/jcp.v65n0411).
- 14. Attala N., Cruccua B.G., Barona C.R. et al. (2010) EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Eur. J. Neurol. (http// doi:10.1111/j.1468-1331.2010.02999.x).
- 15. Busse D.W., Sadeghirad B., Oparin Y. et al. (2020) Management of Acute Pain From Non-Low Back, Musculoskeletal Injuries. A Systematic Review and Network Meta-analysis of Randomized Trials. (https://doi.org/10.7326/M19-3601).
- 16. Macfarlane G.J., Kronisch C., Dean L.E. еt al. (2017) EULAR revised recommendations for the management of fibromyalgia. BMJ J. (http// doi: 10.1136/annrheumdis-2016-209724).
- 17. OARSI guidelines for the non-surgical management of knee osteoarthritis (2019) Osteoarthritis and Cartilage (http// doi: 10.1016/j.joca.2019.06.011).
- 18. Hieronymus F., Lisinski A., Nilsson S. et al. (2018) Efficacy of selective serotonin reuptake inhibitors in the absence of side effects: a mega-analysis of citalopram and paroxetine in adult depression. Mol. Psychiatr., 23: 1731–1736 (http// doi: 10.1038/mp.2017.147).
- 19. Fountoulakis K.N., McIntyre R.S., Carvalho A.F. (2015) From randomized controlled trials of antidepressant drugs to the meta-analytic synthesis of evidence: methodological aspects lead to discrepant findings. Curr. Neuropharmacol., 13: 605–615. http// doi: 10.2174/1570159X13666150630174343
 Лікувальна стратегія при ревматоїдному артриті передусім спрямована на зменшення вираженості больового синдрому з одночасною модифікацією активності імунокомпетентних клітин та зменшенням проявів запалення. Вибір методу та схеми лікування зумовлений активністю та перебігом захворювання. На початкових стадіях ревматоїдного артриту, передусім оліго- та моноартриту, рекомендовано застосування нестероїдних протизапальних препаратів, механізм дії яких полягає у зменшенні вираженості запального процесу, больових відчуттів та покращенні стану опорно-рухового апарату. Однак прогресуючий характер захворювання та необхідність проведення тривалої, часто пожиттєвої протизапальної терапії пов’язані з підвищеним ризиком розвитку побічних ефектів від застосування нестероїдних протизапальних препаратів, зокрема тяжких ушкоджень органів травлення. Крім того, накопичений клінічний досвід свідчить про загрозу хронізації больового синдрому, що пов’язане зі змішаним характером больового відчуття внаслідок приєднання нейропатичного компоненту. Завдяки зміні підходів до діагностики ревматоїдного артриту стало можливим виокремлення різних фенотипів захворювання, один з яких характеризується схильністю до розвитку тривожно-депресивних розладів. Наразі є підстави вважати нейропсихічні порушення основним чинником когнітивних порушень та алекситимії, внаслідок чого знижуються прихильність пацієнта до лікування та якість його життя. Сучасним клінічним рішенням для пацієнтів із хронічним больовим синдромом може бути застосування антидепресивних препаратів із групи селективних інгібіторів зворотного захоплення серотоніну та норадреналіну. Рекомендації щодо їх застосування в рамках загальної медичної практики базуються на задовільній переносимості препаратів та високій терапевтичній ефективності у пацієнтів із помірними та тяжкими депресивними розладами при значно нижчій кардіотоксичності порівняно з трициклічними антидепресантами. Полегшення клінічної картини депресії у пацієнтів із ревматоїдним артритом на тлі застосування інгібіторів зворотного захоплення серотоніну та норадреналіну зумовлює зменшення кількості епізодів перемикання терапії основного захворювання та часу досягнення лікувальної мети — максимального зниження активності захворювання. Про це у ході Міждисциплінарного тренінгу «Психосоматична практика: ревматологія», який відбувся в онлайн-форматі 31 березня 2021 р., розповіла Ірина Головач, доктор медичних наук, професор, керівник Центру ревматології Клінічної лікарні «Феофанія» (Київ).
Лікувальна стратегія при ревматоїдному артриті передусім спрямована на зменшення вираженості больового синдрому з одночасною модифікацією активності імунокомпетентних клітин та зменшенням проявів запалення. Вибір методу та схеми лікування зумовлений активністю та перебігом захворювання. На початкових стадіях ревматоїдного артриту, передусім оліго- та моноартриту, рекомендовано застосування нестероїдних протизапальних препаратів, механізм дії яких полягає у зменшенні вираженості запального процесу, больових відчуттів та покращенні стану опорно-рухового апарату. Однак прогресуючий характер захворювання та необхідність проведення тривалої, часто пожиттєвої протизапальної терапії пов’язані з підвищеним ризиком розвитку побічних ефектів від застосування нестероїдних протизапальних препаратів, зокрема тяжких ушкоджень органів травлення. Крім того, накопичений клінічний досвід свідчить про загрозу хронізації больового синдрому, що пов’язане зі змішаним характером больового відчуття внаслідок приєднання нейропатичного компоненту. Завдяки зміні підходів до діагностики ревматоїдного артриту стало можливим виокремлення різних фенотипів захворювання, один з яких характеризується схильністю до розвитку тривожно-депресивних розладів. Наразі є підстави вважати нейропсихічні порушення основним чинником когнітивних порушень та алекситимії, внаслідок чого знижуються прихильність пацієнта до лікування та якість його життя. Сучасним клінічним рішенням для пацієнтів із хронічним больовим синдромом може бути застосування антидепресивних препаратів із групи селективних інгібіторів зворотного захоплення серотоніну та норадреналіну. Рекомендації щодо їх застосування в рамках загальної медичної практики базуються на задовільній переносимості препаратів та високій терапевтичній ефективності у пацієнтів із помірними та тяжкими депресивними розладами при значно нижчій кардіотоксичності порівняно з трициклічними антидепресантами. Полегшення клінічної картини депресії у пацієнтів із ревматоїдним артритом на тлі застосування інгібіторів зворотного захоплення серотоніну та норадреналіну зумовлює зменшення кількості епізодів перемикання терапії основного захворювання та часу досягнення лікувальної мети — максимального зниження активності захворювання. Про це у ході Міждисциплінарного тренінгу «Психосоматична практика: ревматологія», який відбувся в онлайн-форматі 31 березня 2021 р., розповіла Ірина Головач, доктор медичних наук, професор, керівник Центру ревматології Клінічної лікарні «Феофанія» (Київ).





