ВВЕДЕНИЕ
Как известно, стволовые структуры головного мозга кровоснабжаются ветвями основной и позвоночных артерий, образующих так называемую систему вертебрально-базилярного бассейна (ВББ). Именно в этих сосудах особенно часто развивается атеросклеротический процесс, обусловливающий стеноз, окклюзию, тромбоз основной, позвоночных артерий или их ветвей. Частота инфаркта в ВББ занимает второе место (20%) после инфаркта в бассейне средней мозговой артерии (Камчатов П.Р., 2004) и составляет 10–14% в структуре всех ишемических инсультов (Віничук С.М., 1999; Toi Н. et al., 2003).
Неврологическая клиника инфаркта ствола головного мозга характеризируется полиморфизмом проявлений и не всегда соотносится с определенным сосудистым бассейном, уровнем поражения интракраниальных отделов позвоночных, основной артерий или их ветвей. Это определяется значительной вариабельностью кровоснабжения ствола головного мозга, наличием аномалий развития сосудов (Kidwell C.S., Warach S., 2003; Камчатов П.Р., 2004). Разнообразие неврологических проявлений, атипичное течение инфаркта ствола головного мозга является также следствием неравномерного поражения артерий ВББ разного калибра при острых нарушениях мозгового кровообращения (ОНМК), что затрудняет установление диагноза исключительно по клиническим неврологическим признакам (Віничук С.М., 1999; Kidwell C.S., Warach S., 2003; Toi Н. et al., 2003; Камчатов П.Р., 2004). Врачи нередко отмечают не ту клиническую картину инсульта, которая описана в клинических руководствах, а его атипичное течение, что затрудняет определение характера ОНМК и выбор адекватной терапии (Віничук С.М., 1999; Камчатов П.Р., 2004). При такой клинической ситуации особенно важно применение методов нейровизуализации, что позволит не только уточнить вид инсульта, но и определить локализацию очага поражения, его размеры, наличие возможной геморрагической трансформации инфаркта, а также масс-эффекта за счет перифокального отека, набухания ткани мозга, ухудшающих функциональный прогноз. Вместе с тем использование обычных методов визуализации не всегда позволяет выявить инфаркт ствола головного мозга в острый период (Kidwell C.S., Warach S., 2003; Toi Н. et al., 2003). Небольших размеров инфаркт ствола головного мозга очень трудно обнаружить при использовании компьютерной томографии из-за артефактов, возникающих от пирамидок височных костей.
Методика рутинной магнитно-резонансной томографии (МРТ) позволяет более достоверно выявить ишемический очаг поражения, однако при наличии нескольких патологических очагов трудно определить степень их давности. Исключение составляют стойкие очаги энцефаломаляции, дающие характерный МР-сигнал от ликвора — гиперинтенсивные на Т2-взвешенных изображениях (Т2-ВИ) и гипоинтенсивные на Т1-взвешенных изображениях (Т1-ВИ), а также гипоинтенсивный МР-сигнал на последовательностях FLAIR (FLuid Attenuated Inversion Recovery) и TIRM (Turbo Inversion Recovery Magnitude) с подавлением МР-сигнала от жидкости. Наиболее трудно выявить очаг инфаркта в продолговатом мозге, особенно в острый период. В таких случаях целесообразно использовать магнитно-резонансную ангиографию (МРА), позволяющую получить дополнительную информацию о состоянии основной и позвоночных артерий, не прибегая к внутривенному введению контрастного вещества. МРА является методом выбора в случаях необходимости быстрой визуализации экстра- и интракраниальных артерий и вен (von Kummer R., 2002).
Относительно новой методикой нейровизуализации является диффузионно-взвешенная магнитно-резонансная томография (ДВ МРТ), которую все чаще используют для диагностики острого инфаркта мозга. По данным T. Neumann-Haefelin и соавторов (1999), с помощью диффузионно-взвешенных изображений (ДВИ) можно определить участки выраженной ишемии головного мозга в течение нескольких минут или часов после развития инсульта, что проявляется снижением измеряемого коэффициента диффузии (ИКД) воды и повышением МР‑сигнала на ДВИ. Ограничение диффузионного движения воды возникает вследствие недостаточности энергии и цитотоксического отека паренхимы мозга. Эти патологические изменения, выявляемые на ДВИ, могут трансформироваться в инфаркт — зону необратимого поражения. В публикациях последних лет приводятся данные о диагностических возможностях ДВИ при остром инфаркте головного мозга супратенториальной локализации (Ahlhelm F. et al., 2002; Fiebach J.B. et al., 2002). Вместе с тем в диагностике инфаркта ствола головного мозга ДВИ менее информативны из-за наличия артефактов, возникающих на границе «воздух — ткань» и связанных с возможным наличием у пациента металлических зубных коронок. Другие авторы положительно оценивают применение ДВ МРТ в диагностике острого инфаркта ствола головного мозга (Oppenheim C. et al., 2000; Kidwell C.S., Warach S., 2003; Toi H. еt al., 2003). Однако в этих работах недостаточно отображена динамика ИКД, тесно связанного с энергетическим дефицитом и цитотоксическим отеком ткани мозга.
Цель нашего исследования — оценка значения неврологических шкал и диагностических возможностей ДВ МРТ при остром инфаркте ствола головного мозга.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клинико-неврологическое обследование и МРТ проведены у 38 пациентов (28 мужчин и 10 женщин) в возрасте от 51 до 89 лет (в среднем — 68,2±1,44 года) с клинической картиной острого ишемического инфаркта ствола головного мозга. Пациенты поступали в течение 7–72 ч после развития инсульта. Основной причиной заболевания был атеросклероз в сочетании с артериальной гипертензией. Степень нарушения неврологических функций оценивали при госпитализации пациентов по шкале NIНSS (National Institutes of Health Stroke Scale, США) в баллах: 0 — нормальное состояние, от 3 до 8 — неврологические нарушения легкой степени, 9–12 — средней степени тяжести, 13–15 — тяжелые нарушения, более 15 — очень тяжелый неврологический дефицит, 34 — кома. Одновременно использовали шкалу B. Hoffenberth, которая предполагает более адекватную оценку клинических параметров при ОНМК в ВББ:
1. Головокружение (при разгибании или повороте головы).
2. Нарушение слуха, шум в ушах.
3. Головная боль в затылочной области.
4. Внутренняя или наружная офтальмоплегия.
5. Дефекты поля зрения, нечеткость зрения, фотопсии.
6. Пирамидные знаки.
7. Нарушения чувствительности.
8. Мозжечковые симптомы.
9. Внезапные падения (drop-attacks).
10. Бульбарные симптомы.
11. Транзиторная глобальная амнезия.
Согласно этой шкале каждый клинический параметр оценивают в баллах (от 0 до 3), максимальная сумма баллов — 33. Клинические проявления от 1 до 11 баллов свидетельствуют о неврологических нарушениях легкой степени, 12–22 баллов — средней степени, от 22 до 33 баллов — тяжелой степени.
МРТ головного мозга проводили на аппарате «Magnetom Symphony» («Siemens») с напряженностью магнитного поля 1,5 Тл. Использовали стандартный протокол сканирования, включающий получение TIRM и Т2-ВИ в аксиальной плоскости, Т1‑ВИ в сагиттальной и коронарной плоскостях, ДВИ в аксиальной плоскости. Для уточнения подтипа инфаркта 17 пациентам выполнена МРА. ДВИ применяли с тремя b-значениями: 0 с/мм2, 500 с/мм2 и 1000 с/мм2 в трех ортогональных плоскостях. Основные параметры ДВИ протокола следующие: TR — 5300 мс; TE — 135,0 и 135,01 мс; количество срезов — 20; толщина среза — 5 мм; distant factor — 0,3; матрица изображений — 100×80×128 точек; поле обзора (field of view/FOV) — 280°; количество сборов — 2. Время сканирования — 1 мин 19 с. Для нивелирования возможных артефактов на уровне стволовых структур от металлических коронок и штифтов ДВИ планировали под углом наклона сетки от 25° до 45° относительно основания лобных долей головного мозга. Для обработки результатов использовали рабочую станцию «Magic View». Вычисляли ИКД в зоне инфаркта и симметрично на контралатеральной стороне.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ фонового неврологического дефицита по шкалеNIHSS у пациентов с острым инфарктом ствола головного мозга свидетельствует, что у большинства (24) пациентов нарушения неврологических функций были легкой степени (7,04±0,42 балла), у 1 — средней степени (9,0 балла), еще у 1 — тяжелой степени (14,0 балла). Согласно шкале B. Hoffenberth клинические расстройства у больных соответствовали 11,78±0,08 балла, то есть неврологические нарушения были близки к параметрам средней степени тяжести. Таким образом, при ОНМК в сосудах ВББ шкала B. Hoffenberth и соавторов (1990) по сравнению со шкалой NIHSS более адекватно отражает нарушения неврологических функций при остром инфаркте ствола головного мозга.
Наиболее часто неврологическими симптомами у больных с острым ишемическим инфарктом ствола головного мозга были: системное головокружение, глазодвигательные расстройства (двоение в глазах, затуманивание зрения, фотопсии), бульбарные нарушения (дизартрия, дисфагия, дисфония), расстройства чувствительности в зонах Зельдера, парез конечностей, альтернирующие синдромы (Вебера, Мийяра — Гублера, Валленберга — Захарченко), нарушение статики и координации движений. Согласно нашим данным ИКДв зоне инфаркта ствола головного мозгав течение первых 7–72 ч колебался от 0,29 до 0,43 (·10–3 мм2/с).
У 9 (23,7%) пациентов структурно-морфологических изменений ткани ствола головного мозга при МРТ не выявлено. У 5 из них неврологические функции восстановились в течение 24 ч — вариант транзиторной ишемической атаки. Мы их не включали в группу анализа. Еще у 4 пациентов неврологический дефицит регрессировал в течение 14–21 дня, что давало основание диагностировать у них малый ишемический инсульт. Отсутствие у этих пациентов морфологических изменений ткани мозга при повторном проведении МРТ давало основание считать, что зона ишемии не трансформировалась в участок инфарктного ядра, что определило ложноотрицательные результаты. У 3 (7,9%) пациентов локализация очага инфаркта не соответствовала предполагаемому сосудистому бассейну (был выявлен в подкорково-капсулярной области и лучистом венце).
Из 26 пациентов, отобранных для дальнейшего анализа в течение 24 ч после развития инфаркта, обследовали 12 пациентов, в том числе 1 — в течение 7 ч, 2 — до 12 ч от начала заболевания; 3 раза обследовали 4 пациентов, 2 раза — 14, 1 раз — 8.
Частота локализации очага инфаркта ствола головного мозга, верифицированного методом нейровизуализации, приведена на рис. 1.
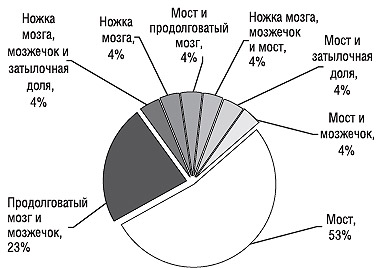
Рис. 1. Частота локализации выявляемого ишемического инфаркта ствола головного мозга
Наиболее часто инфаркт выявляли в области моста (53%) и продолговатого мозга (23%), реже — в области ножек мозга (4%). Нередко инфаркты ствола мозга сочетались с очагами инфаркта в области полушарий мозжечка, затылочных долях мозга (рис. 2).
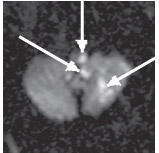
Рис. 2. Острый ишемический инфаркт ствола мозга и мозжечка (19 ч после развития). ДВИ (аксиальная проекция): в левых отделах родолговатого мозга, левой гемисфере мозжечка определяются гиперинтенсивные очаги, соответствующие острому инфаркту
По клиническим и МРТ-характеристикам они соответствовали малому ишемическому инсульту или лакунарному инфаркту мозга. У 1 пациента инфаркт с локализацией в ножке мозга, полушарии мозжечка и затылочной доле осложнился геморрагической трансформацией очага в ножке мозга; больной умер.
Выявленные низкие величины ИКД сохранялись в течение длительного времени и были более выраженными при инфарктах моста. Очаг инфаркта, ранее локализовавшийся в продолговатом мозге, при контрольном исследовании (период наблюдения — 16–50 дней после инсульта) не был выявлен у 3 пациентов из 6. Очаги инфаркта, диаметр которых при первом исследовании составлял более 1 см, чаще увеличивались при повторном проведении МРТ. Такой закономерности не отмечено при очагах инфаркта диаметром до 0,5 см. По данным МРА признаки стеноза одной из позвоночных артерий выявляли у 4 пациентов, расширение основной артерии — у 1, атеросклеротические изменения магистральных артерий головного мозга регистрировали у всех пациентов.
Результаты нашего исследования свидетельствуют, что в период до 24 ч после начала инсульта инфарктный очаг не выявлен у 33% пациентов, а чувствительность ДВИ в выявлении острого инфаркта ствола головного мозга на протяжении этого времени составила 67%. По данным С. Oppenheim и соавторов (2000), в течение 24 ч от проявления клинических симптомов ложноотрицательные результаты выявляли у 34% обследованных с инфарктом ствола головного мозга. H. Toi и соавторы (2003) на ДВИ, полученных в течение 2 ч после клинических проявлений инфаркта, не выявили очагов поражения у 2 (11%) пациентов из 18, но обнаружили инфарктную зону при повторных исследованиях через 19 и 24 ч соответственно. В нашем исследовании у 1 пациента, обследованного 2 раза в течение 24 ч после развития инфаркта (через 12 ч и 23 ч соответственно), на первом ДВИ достоверных признаков ишемии не выявлено (рис. 3а), но на повторном ДВИ обнаружены ишемические очаги в правой ножке и правой затылочной доле мозга (рис. 3б).
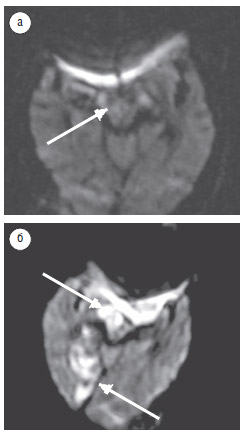
Рис. 3. Пациент М., 87 лет: а — ДВИ (аксиальная проекция), срез на уровне ножек мозга, через 12 ч после развития заболевания; в правой ножке
мозга — незначительное повышение МР-сигнала, предположительно — очаг ишемии; б — ДВИ (аксиальная проекция), срез на уровне ножек
мозга, через 23 ч после развития заболевания; в правой ножке мозга и в правой затылочной области определяются гиперинтенсивные очаги,
соответствующие острому инфаркту
Неинформативность методики ДВИ в определении острого ишемического поражения при локализации в стволе головного мозга можно объяснить двумя факторами. Во-первых, наличием малых ишемических очагов, поскольку перфорирующие артерии васкуляризируют очень маленькие зоны ствола головного мозга. По-видимому, большая часть ложноотрицательных результатов у пациентов с инфарктом ствола головного мозга и незначительным или обратимым неврологическим дефицитом была обусловлена наличием ишемического очага ниже пространственного разрешения изображения (Oppenheim C. et al., 2000; Toi Н. et al., 2003). Во-вторых, нейроны ствола головного мозга (образования более старого в филогенетическом отношении) более стойкие к ишемии, чем нейроны более молодых эволюционно полушарий большого мозга. Это могло быть одной из причин более высокой толерантности их к ишемии и более позднего развития цитотоксического отека ткани ствола головного мозга (Oppenheim C. et al., 2000; Rovira A. et al., 2002; Toi H. et al., 2003). Как известно, ДВИ отображают наличие цитотоксического отека в ишемических очагах ярким сигналом (рис. 4), который соответствует темному сигналу на карте диффузии (рис. 5), обусловленному низким ИКД.
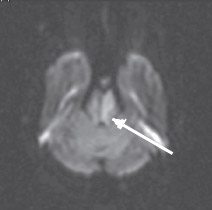
Рис. 4. Острый инфаркт моста головного мозга. ДВИ (аксиальная проекция) через 7 ч после развития заболевания. Гиперинтенсивный (яркий)
МР-сигнал в левой половине моста отображает цитотоксический отек

Рис. 5. Острый инфаркт моста головного мозга. Карта диффузии (аксиальная проекция). Гипоинтенсивный (темный) МР-сигнал в левой
половине моста соответствует низкому ИКД, обусловленному цитотоксическим отеком
H. Toi и соавторы (2003) в оценке ишемических поражений использовали соотношение ИКД на стороне ишемического очага и ИКД контралатеральной стороны, то есть определяли так называемое ИКДс. Сравнивая полученные ИКДс у пациентов с инфарктом ствола головного мозга с аналогичными величинами ИКДс инфаркта коры супратенториальной локализации, авторы установили, что ИКДс медленнее снижалось при инфаркте ствола головного мозга по сравнению с инфарктом коры супратенториальной локализации. Было высказано предположение, что сложность идентификации инфаркта ствола головного мозга может быть связана с медленным снижением ИКД, причина которого не совсем ясна. Предполагают, что одной из причин медленного снижения ИКД может быть то, что инфаркт ствола мозга в большинстве случаев является лакунарным или протекает по типу малого инсульта. Это предположение подтверждается данными нашего исследования, согласно которым низкий ИКД, сохраняющийся в течение длительного периода, был наиболее характерен для лакунарного инфаркта, обусловленного изменениями мелких перфорирующих ветвей. Однако К. Becker и соавторы (1996) предполагают, что вовлечение в патологический процесс малого количества перфорирующих артерий ствола головного мозга и хорошее коллатеральное кровоснабжение может обусловить ограничение повреждения паренхимы мозга даже при окклюзии ветвей ВББ.
Считается, что с помощью перфузионной МРТ также нельзя достоверно определять гипоперфузию ткани при инфаркте ствола головного мозга, а поэтому трудно идентифицировать диффузионно-перфузионные несоответствия и использовать их для определения клинического течения и исхода заболевания (Becker K. et al., 1996; Oppenheim C. et al., 2000; Toi H. et al., 2003; Bacci A., 2004).
ВЫВОДЫ
При клинико-нейровизуализационном обследовании пациентов с острым ишемическим инфарктом в ВББ выявлены неврологические и структурно-морфологические нарушения, которые в основном были обусловлены очаговым поражением моста, продолговатого мозга, реже — ножек мозга. Нередко отмечали очаг инфаркта в стволе головного мозга и затылочной доле мозга или полушариях мозжечка. Иногда лакунарные инфаркты выявляли в разных отделах ствола головного мозга (ножки мозга+мост; мост+ продолговатый мозг). При ОНМК в сосудах ВББ шкала B. Hoffenberth и соавторов (1990) по сравнению со шкалой NIHSS более адекватно отражает нарушения неврологических функций в стволе головного мозга.
Методом выбора лучевой диагностики острого инфаркта ствола головного мозга является МРТ; изменения МР-сигнала, выявленные отсрочено после развития фокальной ишемии, свидетельствуют о развитии необратимого поражения ткани мозга, формировании ядра инфаркта. ДВ МРТ является информативной методикой, использование которой в клинической практике позволяет выявить очаги острой ишемии в стволе головного мозга в течение нескольких часов после развития инфаркта до того, как они визуализируются с помощью стандартных импульсных последовательностей. Паренхима головного мозга после фокальной церебральной ишемии с высоким МР-сигналом на ДВИ и с низким ИКД отображает ишемическую пенумбру (полутень), т.е. ткань в состоянии риска, в которой либо могут произойти необратимые нарушения — гибель нейронов, либо она может восстановиться после реперфузии. Пациентам с острым инфарктом ствола головного мозга показано МРТ-исследование в динамике.
ЛИТЕРАТУРА
-
- Віничук С.М. (1999) Судинні захворювання нервової системи. Наук. думка, Київ, 250 с.
- Камчатов П.Р. (2004) Вертебрально-базилярная недостаточность. РМЖ, 12(10): 614–616.
- Ahlhelm F., Schneider G., Backens M., Reith W., Hagen T. (2002) Time course of the apparent diffusion coefficient after cerebral infarction. Eur. Radiol., 12(9): 2322–2329.
- Bacci A. (2004) The use of diffusion and perfusion sequences in neuroradiological practice. Rivista di neuroradiologia, 17(5): 676–687.
- Becker K., Purcell L.L., Hacke W., Hanley D.F. (1996) Vertebrobasilar thrombosis: diagnosis, management, and the use of intra-arterial thrombosis. Crit. Care Med., 24(10): 1729–1742.
- Fiebach J.B., Jansen O., Schellinger P.D., Heiland S., Hacke W., Sartor K. (2002) Serial analysis of the apparent diffusion coefficient time course in human stroke. Neuroradiology, 44(4): 294–298.
- Kidwell C.S., Warach S. (2003) Acute ischemic cerebrovascular syndrome: diagnostic criteria. Stroke, 34(12): 2995–2998.
- von Kummer R. (2002) From stroke imaging to treatment. In: Stroke: clinical aspects and imaging (teaching courses of the ENS), p. 5–24.
- Neumann-Haefelin T., Wittsack H.J., Wenserski F., Siebler M., Seitz R.J., Modder U., Freund H.J. (1999) Diffusion- and perfusion-weighted MRI. The DWI/PWI mismatch region in acute stroke. Stroke, 30(8): 1591–1597.
- Oppenheim C., Stanescu R., Dormont D., Crozier S., Marro B., Samson Y., Rancurel G., Marsault C. (2000) False-negative diffusion-weighted MR findings in acute ischemic srtoke. AJNR Am. J. Neuroradiol., 21(8): 1434–1440.
- Rovira A., Rovira-Gols A., Pedraza S., Grive E., Molina C., Alvarez-Sabin J. (2002) Diffusion-weighted MR imaging in the acute phase of transient ischemic attacks. AJNR Am. J. Neuroradiol., 23(1): 77–83.
- Toi H., Uno M., Harada M., Yoneda K., Morita N., Matsubara S., Satoh K., Nagahiro S. (2003) Diagnosis of acute brain-stem infarcts using diffusion-weighed MRI. Neurology, 45(6): 352–356.
ДІАГНОСТИКА ГОСТРОГО ІНФАРКТУ СТОВБУРА ГОЛОВНОГО МОЗКУ З ВИКОРИСТАННЯМ КЛІНІЧНИХ КРИТЕРІЇВ ТА ДИФУЗІЙНО-ЗВАЖЕНОЇ МАГНІТНО-РЕЗОНАНСНОЇ ТОМОГРАФІЇ
Резюме. Частота інфаркту у вертебрально-базилярному басейні (ВББ) займає друге місце після інфаркту у басейні середньої мозкової артерії. Мета нашого дослідження — оцінка значення неврологічних шкал і діагностичних можливостей дифузійно-зваженої магнітно-резонансної томографії (ДЗ МРТ). Проведено клініко-нейровізуалізаційний аналіз у 38 пацієнтів з клінічною картиною гострого інфаркту стовбура головного мозку. Результати дослідження свідчать, що у випадках гострого порушення мозкового кровообігу в судинах ВББ шкала B. Hoffenberth порівняно зі шкалою NIНSS більш адекватно відображає порушення неврологічних функцій при гострому інфаркті стовбура головного мозку. ДЗ МРТ є інформативною методикою, використання якої в клінічній практиці дозволяє виявити осередки гострої ішемії у стовбурі головного мозку протягом кількох годин після розвитку інфаркту до того, як вони візуалізуються з допомогою стандартних імпульсних послідовностей. Для інфаркту ствобура головного мозку характерний низький вимірюваний коефіцієнт дифузії, що зберігається протягом тривалого часу і найбільшою мірою відповідає лакунарному інфаркту.
Ключові слова:інфаркт стовбура головного мозку, дифузійно-зважена магнітно-резонансна томографія, клінічні діагностичні шкали
Summary. Frequency of infarcts in the vertebrobasilar system possesses the second place after the same of middle cerebral arteries infarcts. The study aimed to estimate significance of neurological scales and possibilities of diffusion-weighted magnetic resonance imaging (MRI) in diagnostics of acute brainstem infarct. Data of clinical evaluation and MRI were analyzed in 38 patients with clinical acute brainstem infarct. The results obtained showed that in patients with acute brainstem infarcts the B. Hottenberth scale reflects neurological disturbances more accurately than NIHSS scale. Diffusion-weighted MRI was find to be informative method that allows to detect acute ischemic lesions during the first hours after stroke, before they became visible on routine MRI. For brainstem infarcts continuous persisting of low ADC values was characteristic, that is more typical for lacunar infarct.
Key words: brainstem infarct, diffusion-weighted magnetic resonance imaging, clinical diagnostic scales





