ВСТУП
Синдроми гіперактивної дисфункції черепних нервів (СГД ЧН), чи (що більш поширено в літературі) нейроваскулярно-компресійні синдроми, передбачають наявність судинної компресії як етіологічного чинника невралгії трійчастого (ТН), язикоглоткового (ЯН) нервів, гемілицевого спазму (ГЛС) (Gardner W.J., 1962; Jannetta P.J., 1980; Møller A.R., 1991). Ряд авторів стверджують, що такий же механізм розвитку мають і синдром Меньєра (СМ), пароксизмальна артеріальна гіпертензія (АГ), спастична кривошия (СК), а за останніми даними і деякі форми цукрового діабету (Jannetta P.J. et al., 1986; Levy E.I. et al., 2001; Зозуля Ю.П., Федірко В.О., 2004; Jannetta P.J., Hollihan L., 2004).
Водночас щодо механізмів патогенезу зазначених синдромів думки розходяться. Якщо вважати, що пусковим механізмом проявів СГД є існуюча тривалий час судинна компресія (Rath S.A. et al., 1996; Burchiel K.J., Slavin K.V., 2000; Devor M. et al., 2002), то досі немає пояснення, чому виникають періоди спонтанної ремісії і чим зумовлені рецидиви при тому, що судинна компресія залишається; від чого залежить інтенсивність больових проявів, як і ступінь гіперактивної дисфункції при залученні рухових чи вегетативних нервів; чому не будь-який контакт судини з нервом призводить до розвитку СГД відповідного нерва.
Ряд авторів (Adams C.B., 1989) аргументовано піддають сумніву чисто судинно-компресійний механізм розвитку СГД. A.R. Møller (1991) також наводить думку про необхідність врахування ще якогось фактора, окрім судинної компресії, для розвитку СГД, вважаючи при цьому, що це має бути процес на рівні ядер відповідних ЧН у стовбурі мозку. Подібну гіпотезу щодо невралгії ТН висловлює і М.А. Сапон (2005а, б), допускаючи при цьому різні рівні та чинники (окрім судинної компресії) подразнення периферичного відділу корінця ТН та гіперзбудження ядер ЧН у стовбурі мозку. На противагу цьому D. Bowsher (1997) вказує на відсутність достовірних підтверджень ураження периферичного відділу ТН, яких не виявили і ми у своїх спостереженнях.
Не заперечуючи думки щодо багатокомпонентності факторів етіопатогенезу як невралгії ТН, так і інших СГД, вважаємо (Федірко В.О., 2003; Федірко В.О. та співавт., 2003), що існує певна закономірність маніфестації та рецидивування цих синдромів залежно від соматичного статусу хворих, передування стресових ситуацій, гострих респіраторних чи герпесвірусних захворювань. Відомо, що герпесвіруси часто наявні у тригемінальних гангліях і разом з тим є повідомлення про наявність імунологічних змін у хворих на невралгію ТН (Мордвинов Г.В., 1994; Мордвинов Г.В., Мунтяну И.Ф., 1994; Лисяный Н.И. (ред.), 1999; Theil D. et al., 2003; Зозуля Ю.П., Федірко В.О., 2004).
Мета роботи — визначити основні фактори патогенезу СГД ЧН та їх роль у лікуванні хворих із зазначеною патологією.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
450 пацієнтів із СГД ЧН були обстежені в Інституті нейрохірургії з 06.1996 по 06.2007 р. Діагноз базувався на скаргах, даних клінічних проявів та перебігу захворювання, клінічному обстеженні, електронейроміографічних дослідженнях (у разі ГЛС); спеціальних програмах магнітно-резонансної томографії (МРТ) для візуалізації нейроваскулярних взаємовідносин в ділянці парастовбурових цистерн задньої черепної ямки (ЗЧЯ), таких як CISS3D, TRUFFY. Середній термін від початку захворювання на час звернення становив 3,5 року. Лише декілька пацієнтів звернулися до Інституту нейрохірургії в період маніфестації захворювання, в той час як більшість — у періоди рецидивів.
Імунологічні дослідження включали визначення рівня лімфоцитів та їх субпопуляцій (CD3+-, CD4+-, CD8+-Т-лімфоцити, CD20+-В-лімфоцити, CD16+-NK-клітини); проліферативної активності лімфоцитів в реакції бласттрансформації лімфоцитів (РБТЛ): спонтанної проліферації, Т-мітоген (фітогемаглютинін) викликаної проліферації, В-мітоген (декстран-сульфат) індукованої проліферації; цитотоксичної активності мононуклеарів; фагоцитарної активності нейтрофільних гранулоцитів; стану гуморального імунітету — циркулюючих імунних комплексів (ЦІК); аутоімунних реакцій: аутоантиген (основний білок мієліну (ОБМ)) індукованої проліферації в РБТЛ; інгібіції адгезії нейтрофільних гранулоцитів нейроспецифічними білками (альбумін, ОБМ, нейроспецифічна єнолаза (НСЄ)); рівня анти-ОБМ аутоантитіл (Лисяный Н.И. (ред.), 1999; Лісяний М.І., Любич Л.Д., 2001).
Також досліджено слину, кров, спинномозкову рідину на герпесвіруси (herpes simplex virus type 1/2 (HSV 1/2), cytomegalovirus (CMV), varicella zoster virus (VZV), Epstein — Barr virus (EBV), human herpesvirus-6, 7 (HHV6, 7)) методом полімеразної ланцюгової реакції (ПЛР) (Amplisens, Genepack, Росія).
Операцію мікросудинної декомпресії корінця відповідного нерва у парастовбуровому просторі виконано у 311 хворих (274 — з невралгією ТН, 14 — з ГЛС, 4 — з СМ, 7 — з невралгією ЯН, 12 — з пароксизмальною АГ в комбінації з іншими синдромами). Повторні втручання у ранній післяопераційний період виконано у 5 пацієнтів у зв’язку з відсутністю протибольового ефекту (всі хворі з невралгією ТН). Ще у 5 (4 — з невралгією ТН, 1 — ЯН) випадках виконано реоперацію в термін від 2 міс до 4 років після першого втручання у зв’язку з рецидивом СГД. 150 пацієнтів з встановленим діагнозом та проведеним вірусологічним та імунологічним дослідженням перебувають під спостереженням у динаміці, при рецидивуванні симптоматики амбулаторно проводять медикаментозне лікування.
Результати клінічних та лабораторних досліджень на до-, інтра- та післяопераційному етапах опрацьовані статистично за допомогою програми Excel.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Усі обстежені пацієнти мали типові прояви або епізоди типових симптомів СГД ЧН. Вони проявлялися поодинокими нападами чи їх пароксизмами, такими як прострільний біль у відповідних ділянках при невралгії ТН чи ЯН; короткочасні спастичні скорочення м’язів одної половини чи окремих груп в половині обличчя при ГЛС; напади запаморочення, вестибулярних порушень, нудоти, блювання, пульсуючого шуму/гіперакузії в одному вусі при СМ; раптові підвищення артеріального тиску до високих цифр та рефрактерність до гіпотензивних препаратів при пароксизмальній АГ, що виникають спонтанно або провокуються незначними рухами, коливаннями емоцій, певними положеннями голови.
Нейроваскулярний контакт — наявність судини у проекції чи по сусідству з корінцем відповідного ЧН, як правило, в його проксимальному відділі і/або деформація корінця нерва та відхилення його від нормального анатомічного розташування відповідно до розташування судини в контакті з ним відзначено при виконанні спеціальних МРТ-програм (CISS3D, TRUFY) та інтраопераційно у більшості хворих (табл. 1, рис. 1, 2).
Таблиця 1
Наявність та характер судинно-нервового контакту
у хворих із СГД ЧН, n (%)
|
Група |
За даними МРТ |
Інтраопераційно |
||
|
Компресія |
Дисторсія корінця |
Відсутність контакту |
||
|
Амбулаторні хворі, n=150 |
134 (89,3) |
|||
|
Прооперовані пацієнти, n=320 |
307 (95,9) |
313 |
5 |
2 |

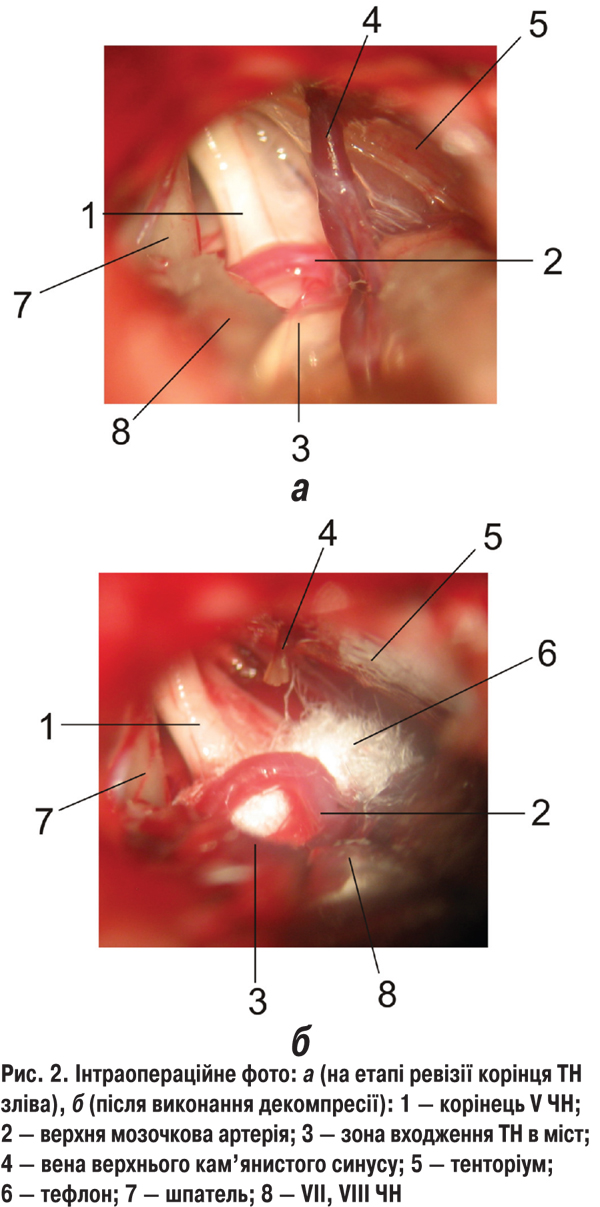
Ретельний аналіз скарг, анамнезу захворювання та факторів, що передували першим ознакам чи рецидивам СГД, виявив чітку залежність СГД маніфестації/рецидивів від негативних стресових ситуацій, які відзначали у 325 (82,9%) випадках із 392, де така інформація була можлива для аналізу. Переохолодження, гостре респіраторне вірусне захворювання чи клінічні прояви герпесвірусної інфекції, гіперчутливість до холодового фактора, періодичний чи тривалий (від тижнів до кількох років) субфебрилітет відзначали у 278 (70,9%) випадках із 392.
Вірусологічні та імунологічні тести виконано у 255 хворих, 105 з яких прооперовані і 150 перебувають під амбулаторним спостереженням (в тому числі 9 із симптоматикою розсіяного склерозу).
Зміни імунологічного статусу та верифікація герпесвірусної інфекції були виявлені на час маніфестації та рецидивів СГД у більшості випадків. Герпесвіруси виявлено при звертанні у 181 (70,9%) пацієнта (табл. 2). Два чи більше типів герпесвірусів виявлено у 95 (37,2%) пацієнтів.
Таблиця 2
Виявлення герпесвірусів методом ПЛР, кількість позитивних результатів (% обстежених)
|
Показник |
Слина |
Кров |
Ліквор |
|
HSV1/2 |
80 (51,3) |
109 (42,7) |
7 (15,5) |
|
CMV |
13 (8,3) |
28 (11,0) |
5 (11,1) |
|
VZV |
19 (12,2) |
43 (16,9) |
3 (6,7) |
|
EBV |
64 (41) |
141 (55,3) |
15 (33,3) |
|
HHV-6 |
95 (61) |
75 (29,4) |
2 (4,4) |
|
HHV-7 |
115 (74) |
126 (49,4) |
|
|
Усього |
386 |
522 |
32 |
Дані імунологічних досліджень свідчать про значиме (p<0,001) зниження субпопуляцій лімфоцитів: CD3+ на 27%; CD8+ на 38%; CD16+ (NK-клітини) на 43%; підвищення B-лімфоцитів: CD20+ на 41% (р<0,05); високий рівень ЦІК (90–360 ум. од.; p<0,01). Активацію аутоімунних реакцій зареєстровано у 233 (91,4%) (p<0,01) із 255 обстежених пацієнтів, а саме: підвищення аутоантиген (ОБМ) індукованої проліферації в РБТЛ на 6–15%; підвищення інгібіції адгезії нейтрофільних гранулоцитів нейроспецифічними протеїнами (альбуміном і ОБМ на 7–28%, НСЄ —на 6–48%); підвищення рівня аутоантитіл до ОБМ методом ІФА до 27–64 ум. од. (табл. 3).
Таблиця 3
Дані імунологічних досліджень, виконані в період маніфестації/рецидивування СГД (відібрано лише відхилення від норми)
|
Показник |
Відсоткове співвідношення |
Абсолютні значення |
||||
|
Діапазон відхилень (%) |
Виявлено від загальної кількості обстежених (%) |
Норма (%) |
Відхилення в межах |
Виявлено від загальної кількості обстежених (%) |
Норма |
|
|
Лімфоцити |
12–29 |
61 |
30–36 |
640–1760 в мм3 |
87 |
2000±240 в мм3 |
|
Т-лімфоцити (CD3+) |
39–55 |
27 |
56–65 |
460–1150 в мм3 |
85 |
1320±170 в мм3 |
|
Т-лімфоцити-супресори (CD8+) |
16–21 |
38 |
22–26 |
210–460 в мм3 |
82 |
680±90 в мм3 |
|
В-лімфоцити (CD20+) |
10–21 |
41 |
8–10 |
190–280 в мм3 |
25 |
170±20 в мм3 |
|
NK-клітини (СD16+) |
9–16 |
43 |
17–20 |
120–310 в мм3 |
47 |
360±50 в мм3 |
|
ЦІК |
85–360 ум. од. |
92 |
70–80 ум. од. |
|||
|
Аутоантиген (ОБМ) індукована проліферація в РБТЛ |
4–15 |
96 |
0–3 |
|||
|
Інгібіція адгезії нейтрофільних гранулоцитів нейроспецифічними протеїнами: альбуміном ОБМ НСЄ |
11–28 6–48 7–34 |
78 82 94 |
5–10 5–7 3–6 |
|||
|
Аутоантитіла до ОБМ |
28–74 ум. од. |
67 |
26,05+/–1,5 ум. од. |
|||
210 хворим проведено консервативне лікування за опрацьованою нами схемою, що включало:
1) симптоматичну терапію: антиконвульсанти, найчастіше карбамазепіни, а останнім часом топірамат у разі невралгії ТН чи ЯН, ГЛС; бетагістин при СМ; гіпотензивні препарати при пароксизмальній АГ;
2) патогенетичну терапію: імуномодулятори (інтерферон альфа, циклоферон, екстракт вилочкової залози, поліоксидоній, гомеопатичні засоби тощо) та препарати противірусної терапії у разі ПЛР-позитивних тестів у крові та/чи лікворі (ацикловір, валацикловір, ганцикловір та імуноглобуліни проти EBV, CMV та ін.).
Наведене лікування було ефективним щодо СГД у 149 (70,9%) випадках з частковою у 95 (63,8%) чи повною у 54 (36,2%) відмовою від симптоматичної терапії. У 140 (77,3%) спостереженнях відзначено клінічне поліпшення загального статусу та негативні аналізи щодо герпесвірусів після лікування.
Імунологічні тести, виконані у 32 хворих з регресом симптомів СГД, свідчать про нормалізацію рівня лімфоцитів у 23 (71,8%) спостереженнях, зниження рівня ЦІК у 29 (90,6%) та зниження нейроспецифічних аутоімунних реакцій у 21 (65,6%) (р<0,01).
Операцію мікросудинної декомпресії виконували у разі тяжких тривалих больових синдромів і часто рецидивуючих СГД. Позитивні результати після операції мікросудинної декомпрессії отримано у 313 (97,8%) спостереженнях: у 292 (91,3%) — повний регрес, у 21 (6,6%) — частковий. У 5 (1,6%) (всі випадки невралгії ТН) відзначили відсутність ефекту. У 2 пацієнтів з пароксизмальною АГ в комбінації з іншими СГД прояви СГД регресували, але показники артеріального тиску при цьому залишалися високими. Результати лікування наведено в табл. 4.
Таблиця 4
Результати хірургічного лікування СГД
|
Результат |
СГД, n (%) |
||||
|
Невралгія ТН |
ГЛС |
СМ |
Невралгія ЯН |
Пароксизмальна АГ |
|
|
Усього прооперовано Регрес симптомів повний частковий Відсутність ефекту |
274 261 (95,3) 8 (2,9) 5 (1,8) |
14 12 (85,7) 2 (14,3) — |
4 3 (75) 1 (25) — |
7 6 (85,7) 1 (14,3) — |
12 4 (нормалізація тиску) (33,3) 6 (на гіпотензивних препаратах) (50) 2 (16,7) |
|
Реоперація в ранній післяопераційний період Регрес симптомів повний частковий Відсутність ефекту |
5 3 1 1 |
— — — — |
— — — — |
— — — — |
— — — — |
|
Віддалені результати Рецидив частковий повний |
18 (6,6) 12 6 |
— |
— |
1 (14,3) 1 |
— |
|
Повторні операції Регрес симптомів повний частковий |
4 3 1 |
— — — |
— — — |
1 — 1 |
— — — |
Вірусологічні та імунологічні тести виконано у 15 із 19 пацієнтів з рецидивами. Герпесвіруси (HSV1, EBV, VZV, CMV, HHV-6, HHV-7) виявлено у 12 з цих пацієнтів. Результати імунологічних тестів свідчать про зміни за тими ж характеристиками, що і в групі обстежених на час маніфестації чи рецидиву СГД при первинному звертанні, а саме: зниження субпопуляції лімфоцитів CD3+, CD8+, CD16+, підвищення субпопуляції В-лімфоцитів CD20+, підвищення ЦІК та виражену нейросенсибілізацію зареєстровано в 14 (93,3%) із 15 обстежених.
Противірусну та імунокоригувальну терапію за виробленою нами схемою застосовано у 12 із 15 пацієнтів, у 9 (75%) випадках відзначали її позитивний ефект щодо регресу проявів СГД тривалістю від 6 міс до 4 років. У 7 осіб групи хворих з рецидивами, які мали задовільні результати після проведеного курсу противірусної та імунокоригувальної терапії — повний регрес чи суттєве зменшення вираженості симптоматики СГД, проведено дослідження імунного статусу та вірусологічні тести. HSV1/2, ННV-7 виявлено у крові методом ПЛР у 2 випадках. Імунограма в 3 випадках була в межах норми, у 4 — відзначено достовірне (р<0,05) зниження показників імуносупресії та нейросенсибілізації. В подальшому, протягом 4 років спостереження цих хворих, рецидивування симптоматики виявлено у 5 із 9 і потребувало повторного медикаментозного лікування. З 19 пацієнтів з рецидивами больових синдромів прооперовані 5, з них 3 прооперовані ще до визначення нами імунологічних змін та виявлення герпесвірусів, 2 отримували вироблений нами комплекс лікування, але внаслідок незадовільного результату і повторного рецидивування симптоматики було прийнято рішення щодо повторного хірургічного втручання.
В усіх 5 прооперованих виявлено той чи інший тип компресії корінця відповідного нерва (адгезія тефлонової прокладки — у 2; венозна компресія — у 2, імовірно, як результат реканалізації вен; і в 1 — артеріальна компресія, ймовірно, внаслідок зміщення тефлонової прокладки). З 5 хворих, прооперованих з приводу рецидивів, у 3 больовий синдром усунено, у 2 відзначено частковий регрес, хворі періодично приймають антиконвульсанти, але в дозах, нижчих, ніж до операції.
Термін «синдром гіперактивної дисфункції черепних нервів» є, на нашу думку, більш обґрунтованим, ніж термін «синдром нейроваскулярної компресії», оскільки при всіх цих синдромах відзначається саме гіперфункція чи подразнення відповідного ЧН, крім того, не в усіх випадках має місце судинна компресія відповідного корінця ЧН, і не лише фактор судинної компресії призводить до розвитку цих синдромів.
У наших спостереженнях у 74% пацієнтів як з невралгією ТН, так і іншими СГД пусковим або причинним фактором виникнення больових нападів було переохолодження, гостре респіраторне захворювання чи стресова ситуація, що передували виникненню нападів. Водночас рецидиви нападів після періодів ремісій дуже часто (68%) виникали навіть після незначного холодового впливу (вітер, протяг, зміна погоди, переохолодження) чи негативного психоемоційного перенавантаження. Така гіперчутливість проявляється у сприйнятті найлегшого вітерця, протягу, мерзлякуватості хворих, частих респіраторних та катаральних проявах, а у пацієнтів із невралгією ТН чи ЯН (які теж надчутливі до найменшого холодового впливу) — у рецидиві больових нападів.
З іншого боку, дуже типовим симптомом у хворих з клінічними проявами вірусного ураження центральної нервової системи (EBV, CMV, HHV-7,8) є гіперчутливість до охолодження. З огляду на визначений нами механізм розвитку невралгій, доцільно розглядати типові, атипові невралгії чи так звані нейропатії та післягерпетичні невралгії як ланки одного ланцюга, в якому об’єднуючим фактором є саме вірусне ураження центральної нервової системи, а «типовість» чи «атиповість» проявів зумовлена наявністю артеріальної чи венозної компресії, рубцево-спайковим процесом на рівні корінця відповідного нерва, попередніми деструктивними втручаннями чи ушкодженням відповідного нерва на периферії (як то після стоматологічних чи отоларингологічних втручань).
Враховуючи викладене, механізм розвитку невралгії ТН при розсіяному склерозі цілком логічно розглядати як результат локальної демієлінізації в зоні входу/виходу корінця ТН у сполученні з вірусним ураженням центральної нервової системи (поліомавірусом чи групою герпесвірусів). Підтвердженням тому можуть бути наші спостереження за 9 такими хворими, у яких рецидиви больових нападів співпадали із поглибленням іншої супутньої неврологічної симптоматики, що в свою чергу співпадало з активізацією вірусного процесу та змінами імунітету за типом імуносупресії та нейросенсибілізації. Дані імунологічних досліджень свідчать про підвищені титри аутоантитіл до ОБМ, НСЄ саме в період загострень больового синдрому. Дані ПЛР на поліомавірус та групу герпесвірусів також свідчать про активізацію процесу. Загалом, можна відзначити, що ряд вірусів, тропних до нервової тканини (група герпесвірусів, поліомавірус), можуть провокувати розвиток СГД ЧН при розвитку в них демієлінізації, трансефаптичної передачі (Møller A.R., 1991; Devor M. et al., 2002) внаслідок тривало існуючої судинної компресії чи рубцево-спайкової компресії.
Тривалий час вважалось, що невралгія є «запалення» ТН. Якщо враховувати визначений нами вірусний компонент та імунологічні зміни у механізмі розвитку цього синдрому, з такою думкою певною мірою можна погодитися.
Рецидиви невралгії, як і інших СГД після операції мікросудинної декомпресії, за наявності у ролі компремуючого агента вени зумовлені тим, що на відміну від артерій під час операції вени значно важче відвести від нерва. Спайки в свою чергу значно частіще виникають після маніпуляцій з венами біля нерва, ніж з артеріями. Вени частіше мають пенетруючий характер розташування, що в свою чергу спричиняє більшу травматизацію окремих волокон корінця при виділенні, коагуляції та пересіченні вени. Це в подальшому проявляється у більшій долі парестезій та гіпестезій у цих хворих порівняно з тими, в яких виявлено артеріальну компресію. Інтраопераційна травматизація в подальшому, ймовірно, призводить до підсиленого рубцево-спайкового процесу. Найімовірніше такий же механізм розвитку рецидивів має місце у випадках мікросудинної декомпресії, яким передували деструктивні хірургічні втручання. Ефективність одного тільки невролізу у хворих з рецидивом невралгії після операції мікросудинної декомпресії слугує підтвердженням цієї гіпотези (Rath S.A. et al., 1996).
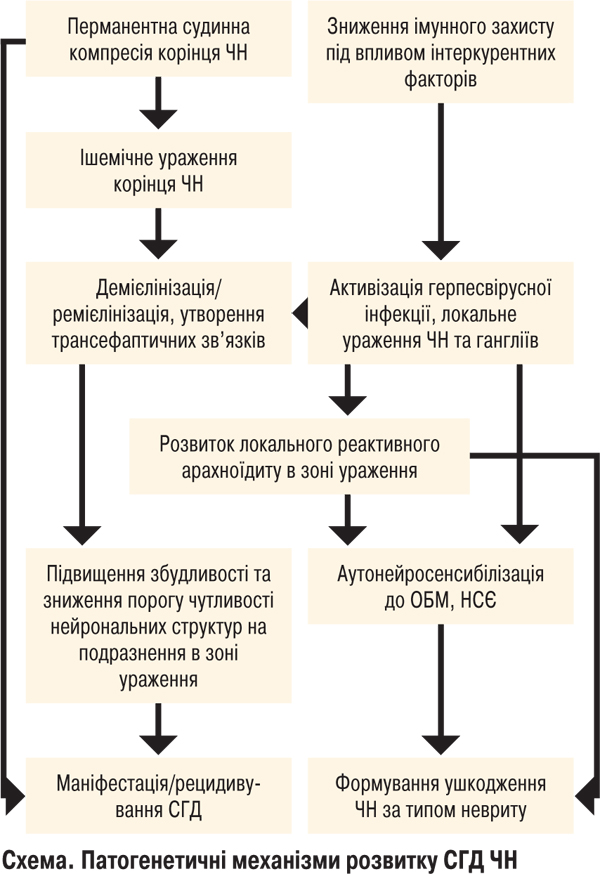
На нашу думку, патогенетичні механізми розвитку СГД можна представити у вигляді схеми.
ВИСНОВКИ
1. Патогенез СГД ЧН зумовлений принаймні двома факторами: судинною компресією відповідного корінця ЧН, як правило, у проксимальній його ділянці та імуносупресією чи прогресуючим аутоімунним враженням, в якому герпесвіруси відіграють провокуючу роль.
2. На маніфестацію чи рецидиви СГД, як і їх ремісії, впливає рівень нейросенсибілізації.
3. Виключення одного з факторів патогенезу СГД веде до зменшення вираженості чи регресу клінічних проявів СГД ЧН.
4. Діагностичний комплекс при СГД має включати методики візуалізації нейроваскулярного конфлікту, а також дослідження імунного статусу та проведення вірусологічних тестів.
5. Лікування СГД має бути патогенетично обґрунтованим і розпочинатися з корекції імунного статусу та противірусної терапії (при виявленні активних форм або носійстві вірусів, тропних до нервової системи).
6. При неефективності консервативної терапії хірургічне лікування має бути спрямованим на усунення компресії відповідного корінця ЧН.
7. Усунення нейроваскулярної компресії є значно стабільнішим чинником порівняно з нормалізацією імунного статусу; відповідно хірургічне лікування дає триваліший результат, ніж консервативна терапія, чи приводить до позбавлення від СГД.
8. Рецидиви СГД після операції мікросудинної декомпресії виникають у разі неповного звільнення корінця нерва від компремуючого агента чи внаслідок рекомпресії, а також імуносупресії та подальшої нейросенсибілізації.
ЛІТЕРАТУРА
- Зозуля Ю.П., Федірко В.О. (2004) Внутрішньочерепні нейроваскулярні компресійні синдроми. Лікування та діагностика, 1: 23–28.
- Лисяный Н.И. (ред.) (1999) Иммунная система головного мозга. ВИПОЛ, Киев, 216 с.
- Лісяний М.І., Любич Л.Д. (2001) Механізми імуно- патологічних процесів при дії радіаційного опромінення. Київ, 198 с.
- Мордвинов Г.В. (1994) Состояние антибактериального и противовирусного иммунитета у больных невралгией тройничного нерва. Журн. невропатологии и психиатрии им. С.С. Корсакова, 4: 11–14.
- Мордвинов Г.В., Мунтяну И.Ф. (1994) Иммунологические аспекты патогенеза и специфической тканевой терапии невралгии тройничного нерва. Журн. невропатологии и психиатрии им. С.С. Корсакова, 6: 22–25.
- Сапон Н.А. (2005а) Вопросы патогенеза невралгии тройничного нерва (постулаты, противоречия и новые подходы). Укр. нейрохірур. журн., 2: 54–59.
- Сапон Н.А. (2005б) Вопросы патогенеза невралгии тройничного нерва (постулаты, противоречия и новые подходы). Укр. нейрохірур. журн., 4: 72–75.
- Федірко В.О. (2003) Синдроми гіперактивної дисфункції черепно-мозкових нервів — фактори та механізми патогенезу. В кн.: Матеріали ІІІ з’їзду нейрохірургів України (23–25 вересня 2003 р., Алушта, Крим), Київ, с. 280.
- Федірко В.О., Васильєва І.Г., Кононенко В.В., Гавриш Р.В., Чопик Н.Г. (2003) Больові синдроми в ділянці обличчя, голови, шиї, пов’язані з герпесвірусами. Анали Мечниківського інституту, 4–5: 60–66.
- Adams C.B. (1989) Microvascular compression: an alternative view and hypothesis. J. Neurosurg., 70(1): 1–12.
- Bowsher D. (1997) Trigeminal neuralgia: an anatomically oriented review. Clin. Anat., 10(6): 409–415.
- Burchiel K.J., Slavin K.V. (2000) On the natural history of trigeminal neuralgia. Neurosurgery, 46(1): 154–155.
- Devor M., Govrin-Lippmann R., Rappaport Z.H. (2002) Mechanism of trigeminal neuralgia: an ultrastructural analysis of trigeminal root specimens obtained during microvascular decompression surgery. J. Neurosurg., 96(3): 532–543.
- Gardner W.J. (1962) Concerning the mechanism of trigeminal neuralgia and hemifacial spasm. J. Neurosurg., 19: 947–958.
- Jannetta P.J. (1980) Neurovascular compression in cranial nerve and systemic disease. Ann Surg., 192(4): 518–525.
- Jannetta P.J., Møller M.B., Møller A.R., Sekhar L.N. (1986) Neurosurgical treatment of vertigo by microvascular decompression of the eighth cranial nerve. Clin. Neurosurg., 33: 645–665.
- Jannetta P.J., Hollihan L. (2004) Type 2 diabetes mellitus, etiology and possible treatment: preliminary report. Surg. Neurol., 61(5): 422–428.
- Levy E.I., Scarrow A.M., Jannetta R.J. (2001) Microvascular decompression in the treatment of hypertension: review and update. Surg. Neurol., 55(1): 2–11.
- Møller A.R. (1991) The cranial nerve vascular compression syndrome: II. A review of pathophysiology. Acta Neurochir. (Wien), 113(1–2): 24–30.
- Rath S.A., Klein H.J., Richter H.P. (1996) Findings and long-term results of subsequent operations after failed microvascular decompression for trigeminal neuralgia. Neurosurgery, 39(5): 933–940.
- Theil D., Derfuss T., Paripovic I., Herberger S., Meinl E., Schueler O., Strupp M., Arbusow V., Brandt T. (2003) Latent herpesvirus infection in human trigeminal ganglia causes chronic immune response. Am. J. Pathol., 163(6): 2179–2184.
Резюме. Клиническое наблюдение пациентов с синдромами гиперактивной дисфункции (СГД) черепных нервов (невралгия тройничного, языкоглоточного нервов, гемилицевой спазм, синдром Меньера и др.), которые имеют необъяснимую манифестацию, рецидивы и ремиссии, побудили нас провести исследование на герпесвирусы и иммунный статус. Контаминация герпесвирусами верифицирована в 71% наблюдений, иммунодефицит и нейросенсибилизация — в 91%. Проведенная противовирусная и иммуномодулирующая терапия дала положительный результат в отношении проявлений СГД в 70% наблюдений. Операцию микрососудистой декомпрессии выполняли в случае неэффективности медикаментозной терапии или частых рецидивов. Заключение: СГД обусловлены не менее чем двумя факторами —сосудистой компрессией соответствующего черепного нерва и иммунодефицитом, нейросенсибилизацией, в которых герпесвирусная инфекция играет провоцирующую роль.
Ключевые слова: синдромы гиперактивной дисфункции черепно-мозговых нервов, сосудистая компрессия, иммуносупрессия, аутонейросенсибилизация. патогенетическое лечение
Summary. Clinical observation of the patients with hyperactive dysfunction syndrome (HDS) (trigeminal and glossopharyngeal neuralgia, hemifacial spasm, Meniere’s syndrome etc.) which have unexplained manifestation, recurrences and remissions urged us to carry out tests on herpesviruses and immune status. Herpesviruses contamination in about 71% patients, immunodeficiency and neurosensitization in 91% have been registered. Treatment with antiviral and immunomodulatory drugs had positive results in 70% cases of HDS. Microvascular decompression surgery was performed in case of ineffective medical treatment or frequent recurrences. Сonclusions: HDS is generated by no less than two factors: vascular compression and immunodeficiency, neurosensitization, in which herpes viruses have a promoting action.
Key words: hyperactive dysfunction syndromes of cranial nerves, neurovascular compression, immunosuppression, autoneurosensitization, pathogenetic treatment
Адреса для листування:
Федірко Володимир Олегович
04050, Київ, вул. Мануїльського, 32
Інститут нейрохірургії ім. А.П. Ромоданова АМН України





